Tratamiento del linfoma de Hodgkin (PDQ®) : Tratamiento - información para profesionales de salud [NCI]
Esta información es producida y suministrada por el Instituto Nacional del Cáncer (NCI, por sus siglas en inglés). La información en este tema puede haber cambiado desde que se escribió. Para la información más actual, comuníquese con el Instituto Nacional del Cáncer a través del Internet en la página web http://cancer.gov o llame al 1-800-4-CANCER.
Información general sobre el linfoma de Hodgkin
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por linfoma de Hodgkin (LH) en los Estados Unidos para 2025:[
- Casos nuevos: 8720.
- Defunciones: 1150.
Hasta el 90 % de los pacientes con diagnóstico reciente de LH se pueden curar con quimioterapia combinada o radioterapia.[
Características anatómicas
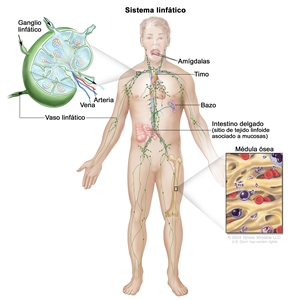
Con más frecuencia, el LH se presenta en grupos de ganglios linfáticos supradiafragmáticos o mediastínicos. El compromiso del anillo de Waldeyer o de los ganglios linfáticos amigdalinos es infrecuente.
Factores de riesgo
Los factores de riesgo del LH son los siguientes:
- Ser adulto joven de 20 a 39 años (con más frecuencia) o adulto mayor de 65 años o más (con menos frecuencia).
- Ser hombre.
- Tener antecedentes de infección por el virus de Epstein-Barr en la adolescencia o durante la infancia.
- Tener un familiar de primer grado con LH.
Características clínicas
Estos y otros signos y síntomas pueden obedecer a un LH otras afecciones.
- Ganglios linfáticos inflamados e indoloros en el cuello, la axila o el área inguinal.
- Fiebre, que se define como de 38 °C o más.
- Sudores nocturnos copiosos y repetidos.
- Pérdida de más del 10 % del peso de referencia en los 6 meses previos al diagnóstico.
- Prurito, en particular después de bañarse o consumir bebidas alcohólicas.
- Fatiga.
El tratamiento del LH debería aliviar estos síntomas en pocos días. Para obtener más información sobre el tratamiento de estos síntomas, consultar
Evaluación diagnóstica
Es posible que la evaluación diagnóstica de los pacientes con linfoma incluya los siguientes procedimientos:
- Biopsia (de preferencia, excisional) con interpretación por un patólogo experto.
- Antecedentes médicos, con especial atención a la presencia y duración de la fiebre, los sudores nocturnos y la pérdida de más del 10 % del peso corporal sin causa aparente en los 6 meses previos.
- Examen físico.
- Pruebas de laboratorio:
- Hemograma completo.
- Velocidad de sedimentación de eritrocitos.
- Perfil bioquímico (electrólitos, nitrógeno ureico sanguíneo, creatinina, calcio, aspartato–aminotransferasa, alanina–aminotransferasa, bilirrubina y fosfatasa alcalina) además de lactato-deshidrogenasa, ácido úrico y fósforo.
- Radiografías.
- Tomografía computarizada (TC) del cuello, el tórax, el abdomen y la pelvis, o imágenes metabólicas (tomografía por emisión de positrones [TEP] con flúor F 18-fludesoxiglucosa), como una TEP combinada con TC (TEP-TC). La TEP combinada con una resonancia magnética quizás sea equivalente a la TEP con TC a la hora de obtener información para la estadificación, utilizando un 25 % de la dosis de radiación.[
33 ]
- Tomografía computarizada (TC) del cuello, el tórax, el abdomen y la pelvis, o imágenes metabólicas (tomografía por emisión de positrones [TEP] con flúor F 18-fludesoxiglucosa), como una TEP combinada con TC (TEP-TC). La TEP combinada con una resonancia magnética quizás sea equivalente a la TEP con TC a la hora de obtener información para la estadificación, utilizando un 25 % de la dosis de radiación.[
- Pruebas de detección del virus de la inmunodeficiencia humana (VIH).
- Pruebas serológicas de la hepatitis B y la hepatitis C.
Todos los estadios del LH se dividen en categorías A y B: categoría B, si hay síntomas generales definidos (descritos más adelante); categoría A, si no hay síntomas de la categoría B. La designación B se adjudica a pacientes con cualquiera de los siguientes síntomas:
- Pérdida de peso sin causa aparente (más del 10 % del peso corporal en los 6 meses previos al diagnóstico).
- Fiebre sin causa aparente con temperaturas superiores a los 38 °C.
- Sudores nocturnos copiosos y repetidos.
Los síntomas B más importantes son fiebre y pérdida de peso. Los sudores nocturnos solos no confieren un pronóstico adverso.
Factores pronósticos
El pronóstico para un determinado paciente depende de varios factores. Los factores más importantes son los siguientes:[
- Presencia o ausencia de síntomas B sistémicos.
- Estadio de la enfermedad.
- Presencia de masas voluminosas.
- Calidad y conveniencia del tratamiento administrado.
Otros factores importantes son los siguientes:[
- Edad.
- Sexo.
- Velocidad de sedimentación de eritrocitos.
- Hematocrito.
- Extensión del compromiso abdominal.
- Número absoluto de sitios con compromiso ganglionar.
La mejor predicción del fracaso terapéutico se obtiene con una TEP-TC después de 2 ciclos de quimioterapia (TEP2).[
Seguimiento
Las recomendaciones para el seguimiento después del tratamiento no se sustentan en la evidencia, pero se han publicado varias opiniones sobre los pacientes de riesgo alto que presentan al inicio una enfermedad en estadio avanzado y los pacientes que logran una remisión que no es del todo completa a juzgar por las TEP-TC después del tratamiento.[
En los pacientes cuyas TEP-TC al final del tratamiento dan un resultado negativo, no se aconseja el uso de imágenes de rutina debido a un riesgo muy bajo de recidiva.[
Entre 6840 pacientes inscritos en los ensayos del German Hodgkin Study Group (GHSG), luego de una mediana de seguimiento de 10,3 años se encontró que 141 pacientes tuvieron una recaída después de 5 años de seguimiento, en comparación con 466 pacientes que tuvieron una recaída durante los primeros 5 años. Es posible que los efectos adversos relacionados con el tratamiento y las recaídas tardías se presenten después de 20 años de seguimiento.[
Efectos adversos a largo plazo del tratamiento
Los pacientes que terminan su tratamiento para el LH tienen riesgo de presentar efectos secundarios a largo plazo que abarcan desde un daño directo en el funcionamiento orgánico o del sistema inmunitario hasta segundas neoplasias malignas. Durante los primeros 15 años posteriores al tratamiento, el LH es la causa principal de muerte. Entre los 15 y 20 años posteriores al tratamiento, la mortalidad acumulada por una segunda neoplasia maligna, enfermedad cardiovascular o fibrosis pulmonar excede la mortalidad acumulada por LH.[
Los sobrevivientes a largo plazo de LH tienen una esperanza de vida más corta que la de la población general.[
Segundas neoplasias malignas
Las recomendaciones sobre los exámenes de detección de segundas neoplasias malignas o el seguimiento de los sobrevivientes a largo plazo se basan en consensos y no en ensayos aleatorizados.[
Tumores sólidos
También se observó un aumento de segundos tumores sólidos; en especial, mesotelioma y cáncer de pulmón, mama, tiroides, hueso o tejido blando, estómago, esófago, colon y recto, cuello uterino, y cabeza y cuello.[
- Al cabo de 15 años de seguimiento, el riesgo es de cerca del 13 %.[
3030 ] - Al cabo de 20 años de seguimiento, el riesgo es de cerca del 17 %.[
3535 ] - Al cabo de 25 años de seguimiento, el riesgo es de cerca del 22 %.[
2727 ,3636 ] - Al cabo de 40 años de seguimiento, el riesgo es de cerca del 48 %.[
3737 ]
En una cohorte de 18 862 sobrevivientes a 5 años de 13 registros poblacionales, se encontró que el riesgo de cáncer de mama, colon y recto fue más alto en los pacientes más jóvenes y se presentó 10 a 25 años antes de la edad recomendada para el inicio de los exámenes de detección rutinaria en la población general.[
El cáncer de pulmón y el cáncer de mama se ubican entre los segundos tumores sólidos más comunes después del tratamiento del LH.
- Cáncer de pulmón. se observa un aumento en la frecuencia de este tipo de cáncer, aun después de la quimioterapia sola; el consumo de tabaco eleva el riesgo de este cáncer.[
3838 ,3939 ,4040 ,4141 ] En un análisis retrospectivo del Surveillance, Epidemiology, and End Results (SEER) Program, la supervivencia específica por estadio disminuyó entre el 30 y el 60 % en los sobrevivientes de LH en comparación con los pacientes que tenían un cáncer de pulmón de células no pequeñas de novo.[4242 ] - Cáncer de mama. se observa un aumento en la frecuencia de este cáncer después de la radioterapia o la terapia de modalidad combinada.[
2727 ,2828 ,4343 ,4444 ,4545 ] El riesgo es más alto en las mujeres que reciben radioterapia antes de los 30 años; en especial, en las niñas que se aproximan a la menarquia.[4646 ] La incidencia de cáncer de mama aumenta de forma considerable 15 años después del tratamiento.[2727 ,4747 ,4848 ] En una cohorte de 1964 mujeres sobrevivientes a 5 años de LH que se trataron entre 1975 y 2008, la doxorrubicina también aumentó el riesgo de cáncer de mama con independencia de la edad a la que se administró el primer tratamiento o de que se hubieran sometido a radioterapia dirigida al tórax.[4949 ] Las sobrevivientes que recibieron más de 200 mg/m2 de doxorrubicina tuvieron un aumento del riesgo 1,5 veces superior (IC 95 %, 1,08–2,10) al de las sobrevivientes que no recibieron doxorrubicina.En dos estudios de casos y controles con 479 pacientes que presentaron cáncer de mama después del tratamiento de LH, se calculó el riesgo absoluto acumulado de cáncer de mama en función de la dosis de radioterapia y la administración de quimioterapia.[
5050 ,5151 ] Después de un seguimiento de 30 a 40 años, el riesgo absoluto acumulado de cáncer de mama por exposición a la radiación oscila entre el 8,5 y el 39,6 %, según la edad en el momento del diagnóstico. En estos estudios de cohortes se observa un aumento constante en el exceso de riesgo acumulado de cáncer de mama después de más de 20 años de seguimiento.[5050 ,5151 ]En un estudio de casos y controles anidado y en un estudio posterior de cohortes, los pacientes que recibieron quimioterapia y radioterapia tuvieron un riesgo más bajo y estadísticamente significativo de presentar cáncer de mama que aquellos tratados con radioterapia sola.[
4343 ,5252 ] Al parecer, la menopausia precoz con menos de 10 años de funcionamiento ovárico intacto explicó la reducción del riesgo en las pacientes sometidas a terapia de modalidad combinada.[5252 ] La reducción del volumen de radiación también disminuyó el riesgo de cáncer de mama después de un LH.[5252 ]
Los efectos tardíos luego de un trasplante autógeno de células madre indicado por el fracaso de la quimioterapia de inducción, incluyen segundas neoplasias malignas, hipotiroidismo, hipogonadismo, herpes zóster, depresión y cardiopatías.[
Cánceres hematológicos
- Leucemia mielógena aguda (LMA). este tipo de leucemia no linfocítica aguda a veces se presenta en los pacientes que reciben terapia de modalidad combinada o quimioterapia combinada sola; en particular, cuando la exposición a los alquilantes es alta.[
3030 ,5454 ]- Al cabo de 10 años de tratamiento con regímenes que contienen mecloretamina, vincristina, procarbazina y prednisona (MOPP), el riesgo de LMA es de cerca del 3 %; la incidencia máxima ocurre entre 5 y 9 años después del tratamiento.[
3030 ,5454 ] El riesgo de leucemia aguda 10 años después de la terapia con doxorrubicina, bleomicina, vinblastina y dacarbazina (ABVD) es menor del 1 %.[5555 ] - En un estudio poblacional con más de 35 000 sobrevivientes durante un período de 30 años, se identificaron 217 casos de LMA. El exceso de riesgo absoluto (ERA) fue significativamente más alto en los pacientes mayores (es decir, >35 años en el momento del diagnóstico) que en los sobrevivientes más jóvenes (ERA, 9,9 vs. 4,2 por 10 000 años-paciente, P <0,001).[
5656 ]
- Al cabo de 10 años de tratamiento con regímenes que contienen mecloretamina, vincristina, procarbazina y prednisona (MOPP), el riesgo de LMA es de cerca del 3 %; la incidencia máxima ocurre entre 5 y 9 años después del tratamiento.[
Otros efectos adversos a largo plazo
El tratamiento del LH también afecta los sistemas endocrino, cardíaco, pulmonar, esquelético e inmunitario. La fatiga crónica puede ser un síntoma debilitante para algunos sobrevivientes a largo plazo.[
Esterilidad. efecto tóxico que se relaciona sobre todo con la quimioterapia, por lo común después del tratamiento con regímenes que contienen MOPP o bleomicina, etopósido, doxorrubicina, ciclofosfamida, vincristina, procarbazina y prednisona (BEACOPP).[
Hipotiroidismo. complicación tardía relacionada sobre todo con la radioterapia.[
Cardiopatía. complicación tardía relacionada en primer lugar con la radioterapia; el riesgo a veces persiste más de 30 años después del primer tratamiento.[
En el ensayo RAPID del Reino Unido, que se realizó entre 2003 y 2010, 183 pacientes con LH en estadio temprano presentaron resultados negativos en la TEP pero aún así recibieron radioterapia dirigida al campo comprometido (RTCC) (20 Gy) después de recibir ABVD.[
Insuficiencia pulmonar. es posible que ocurra esta complicación como resultado de la radioterapia dirigida al campo de manto; por lo general, esta insuficiencia no es evidente desde el punto de vista clínico y la recuperación en las pruebas pulmonares a menudo se observa después de 2 o 3 años.[
Necrosis ósea. la necrosis avascular en tejido óseo se ha observado en pacientes tratados con quimioterapia y es más probable que se relacione con la terapia de corticoesteroides.[
Septicemia bacteriana. aunque es infrecuente, es posible que se presente septicemia después de la esplenectomía que se realiza durante la laparotomía de estadificación para el LH;[
Fatiga. síntoma que más notifican los pacientes que terminaron la quimioterapia y la radioterapia. En un estudio con diseño de casos y controles, la mayoría de los sobrevivientes de LH notificaron que padecieron de fatiga intensa durante más de 6 meses después del tratamiento, en comparación con los controles emparejados por edad. En los cuestionarios de calidad de vida administrados a 5306 pacientes de los ensayos del GHSG se observó que el 20 % de los pacientes se quejaron de fatiga grave después de 5 años del tratamiento; estos pacientes tuvieron un aumento significativo de problemas relacionados con el empleo y la estabilidad económica.[
Deterioro neurocognitivo. Al cabo de una mediana de 23 años desde el diagnóstico, 1760 sobrevivientes de LH que se trataron en la niñez se compararon con 3180 hermanos y hermanas. Se notificaron tasas significativamente más altas de pérdida de memoria (8,1 vs. 5,7 %; P < 0,05), ansiedad (7,0 vs. 5,4 %; P < 0,05), desempleo (9,6 vs. 4,4 %; P < 0,05), depresión (9, vs. 7,0 %; P < 0,05) y deterioro de la calidad de vida (11,2 vs. 3,0 %; P < 0,05).[
Referencias:
- American Cancer Society: Cancer Facts and Figures 2025. American Cancer Society, 2025.
Available onlineAvailable online . Last accessed January 16, 2025. - Brice P, de Kerviler E, Friedberg JW: Classical Hodgkin lymphoma. Lancet 398 (10310): 1518-1527, 2021.
- Picardi M, Cavaliere C, Della Pepa R, et al.: PET/MRI for staging patients with Hodgkin lymphoma: equivalent results with PET/CT in a prospective trial. Ann Hematol 100 (6): 1525-1535, 2021.
- Cosset JM, Henry-Amar M, Meerwaldt JH, et al.: The EORTC trials for limited stage Hodgkin's disease. The EORTC Lymphoma Cooperative Group. Eur J Cancer 28A (11): 1847-50, 1992.
- Evens AM, Helenowski I, Ramsdale E, et al.: A retrospective multicenter analysis of elderly Hodgkin lymphoma: outcomes and prognostic factors in the modern era. Blood 119 (3): 692-5, 2012.
- Agostinelli C, Gallamini A, Stracqualursi L, et al.: The combined role of biomarkers and interim PET scan in prediction of treatment outcome in classical Hodgkin's lymphoma: a retrospective, European, multicentre cohort study. Lancet Haematol 3 (10): e467-e479, 2016.
- Gallamini A, Rossi A, Patti C, et al.: Interim PET-adapted chemotherapy in advanced Hodgkin lymphoma: results of the second interim analysis of the Italian GITIL/FIL DH0607 trial. [Abstract] Hematol Oncol 33 (Suppl 1): A-118, 100-180, 2015.
- Spina V, Bruscaggin A, Cuccaro A, et al.: Circulating tumor DNA reveals genetics, clonal evolution, and residual disease in classical Hodgkin lymphoma. Blood 131 (22): 2413-2425, 2018.
- Cottereau AS, Versari A, Loft A, et al.: Prognostic value of baseline metabolic tumor volume in early-stage Hodgkin lymphoma in the standard arm of the H10 trial. Blood 131 (13): 1456-1463, 2018.
- Akhtari M, Milgrom SA, Pinnix CC, et al.: Reclassifying patients with early-stage Hodgkin lymphoma based on functional radiographic markers at presentation. Blood 131 (1): 84-94, 2018.
- Moskowitz AJ, Schöder H, Gavane S, et al.: Prognostic significance of baseline metabolic tumor volume in relapsed and refractory Hodgkin lymphoma. Blood 130 (20): 2196-2203, 2017.
- Hoppe RT, Advani RH, Ai WZ, et al.: Hodgkin lymphoma, version 2.2012 featured updates to the NCCN guidelines. J Natl Compr Canc Netw 10 (5): 589-97, 2012.
- Ng A, Constine LS, Advani R, et al.: ACR Appropriateness Criteria: follow-up of Hodgkin's lymphoma. Curr Probl Cancer 34 (3): 211-27, 2010 May-Jun.
- Armitage JO: Who benefits from surveillance imaging? J Clin Oncol 30 (21): 2579-80, 2012.
- Picardi M, Pugliese N, Cirillo M, et al.: Advanced-stage Hodgkin lymphoma: US/chest radiography for detection of relapse in patients in first complete remission--a randomized trial of routine surveillance imaging procedures. Radiology 272 (1): 262-74, 2014.
- El-Galaly TC, Mylam KJ, Brown P, et al.: Positron emission tomography/computed tomography surveillance in patients with Hodgkin lymphoma in first remission has a low positive predictive value and high costs. Haematologica 97 (6): 931-6, 2012.
- Hartridge-Lambert SK, Schöder H, Lim RC, et al.: ABVD alone and a PET scan complete remission negates the need for radiologic surveillance in early-stage, nonbulky Hodgkin lymphoma. Cancer 119 (6): 1203-9, 2013.
- Hapgood G, Zheng Y, Sehn LH, et al.: Evaluation of the Risk of Relapse in Classical Hodgkin Lymphoma at Event-Free Survival Time Points and Survival Comparison With the General Population in British Columbia. J Clin Oncol 34 (21): 2493-500, 2016.
- Bröckelmann PJ, Goergen H, Kohnhorst C, et al.: Late Relapse of Classical Hodgkin Lymphoma: An Analysis of the German Hodgkin Study Group HD7 to HD12 Trials. J Clin Oncol 35 (13): 1444-1450, 2017.
- Mauch PM, Kalish LA, Marcus KC, et al.: Long-Term Survival in Hodgkin's Disease Cancer J Sci Am 1 (1): 33-42, 1995.
- Aisenberg AC: Problems in Hodgkin's disease management. Blood 93 (3): 761-79, 1999.
- Longo DL, Armitage JO: Controversies in the treatment of early-stage Hodgkin's lymphoma. N Engl J Med 372 (17): 1667-9, 2015.
- Aleman BM, van den Belt-Dusebout AW, Klokman WJ, et al.: Long-term cause-specific mortality of patients treated for Hodgkin's disease. J Clin Oncol 21 (18): 3431-9, 2003.
- Sud A, Thomsen H, Sundquist K, et al.: Risk of Second Cancer in Hodgkin Lymphoma Survivors and Influence of Family History. J Clin Oncol 35 (14): 1584-1590, 2017.
- de Vries S, Schaapveld M, Janus CPM, et al.: Long-Term Cause-Specific Mortality in Hodgkin Lymphoma Patients. J Natl Cancer Inst 113 (6): 760-769, 2021.
- Ng AK: Current survivorship recommendations for patients with Hodgkin lymphoma: focus on late effects. Blood 124 (23): 3373-9, 2014.
- Dores GM, Metayer C, Curtis RE, et al.: Second malignant neoplasms among long-term survivors of Hodgkin's disease: a population-based evaluation over 25 years. J Clin Oncol 20 (16): 3484-94, 2002.
- Franklin J, Pluetschow A, Paus M, et al.: Second malignancy risk associated with treatment of Hodgkin's lymphoma: meta-analysis of the randomised trials. Ann Oncol 17 (12): 1749-60, 2006.
- Hodgson DC, Gilbert ES, Dores GM, et al.: Long-term solid cancer risk among 5-year survivors of Hodgkin's lymphoma. J Clin Oncol 25 (12): 1489-97, 2007.
- Swerdlow AJ, Higgins CD, Smith P, et al.: Second cancer risk after chemotherapy for Hodgkin's lymphoma: a collaborative British cohort study. J Clin Oncol 29 (31): 4096-104, 2011.
- Chowdhry AK, McHugh C, Fung C, et al.: Second primary head and neck cancer after Hodgkin lymphoma: a population-based study of 44,879 survivors of Hodgkin lymphoma. Cancer 121 (9): 1436-45, 2015.
- Dores GM, Curtis RE, van Leeuwen FE, et al.: Pancreatic cancer risk after treatment of Hodgkin lymphoma. Ann Oncol 25 (10): 2073-9, 2014.
- Rigter LS, Spaander MCW, Aleman BMP, et al.: High prevalence of advanced colorectal neoplasia and serrated polyposis syndrome in Hodgkin lymphoma survivors. Cancer 125 (6): 990-999, 2019.
- Geurts YM, Shakir R, Ntentas G, et al.: Association of Radiation and Procarbazine Dose With Risk of Colorectal Cancer Among Survivors of Hodgkin Lymphoma. JAMA Oncol 9 (4): 481-489, 2023.
- O'Brien MM, Donaldson SS, Balise RR, et al.: Second malignant neoplasms in survivors of pediatric Hodgkin's lymphoma treated with low-dose radiation and chemotherapy. J Clin Oncol 28 (7): 1232-9, 2010.
- Bonadonna G, Viviani S, Bonfante V, et al.: Survival in Hodgkin's disease patients--report of 25 years of experience at the Milan Cancer Institute. Eur J Cancer 41 (7): 998-1006, 2005.
- Schaapveld M, Aleman BM, van Eggermond AM, et al.: Second Cancer Risk Up to 40 Years after Treatment for Hodgkin's Lymphoma. N Engl J Med 373 (26): 2499-511, 2015.
- van Leeuwen FE, Klokman WJ, Stovall M, et al.: Roles of radiotherapy and smoking in lung cancer following Hodgkin's disease. J Natl Cancer Inst 87 (20): 1530-7, 1995.
- Swerdlow AJ, Schoemaker MJ, Allerton R, et al.: Lung cancer after Hodgkin's disease: a nested case-control study of the relation to treatment. J Clin Oncol 19 (6): 1610-8, 2001.
- Travis LB, Gospodarowicz M, Curtis RE, et al.: Lung cancer following chemotherapy and radiotherapy for Hodgkin's disease. J Natl Cancer Inst 94 (3): 182-92, 2002.
- Lorigan P, Radford J, Howell A, et al.: Lung cancer after treatment for Hodgkin's lymphoma: a systematic review. Lancet Oncol 6 (10): 773-9, 2005.
- Milano MT, Li H, Constine LS, et al.: Survival after second primary lung cancer: a population-based study of 187 Hodgkin lymphoma patients. Cancer 117 (24): 5538-47, 2011.
- van Leeuwen FE, Klokman WJ, Stovall M, et al.: Roles of radiation dose, chemotherapy, and hormonal factors in breast cancer following Hodgkin's disease. J Natl Cancer Inst 95 (13): 971-80, 2003.
- Wahner-Roedler DL, Nelson DF, Croghan IT, et al.: Risk of breast cancer and breast cancer characteristics in women treated with supradiaphragmatic radiation for Hodgkin lymphoma: Mayo Clinic experience. Mayo Clin Proc 78 (6): 708-15, 2003.
- Travis LB, Hill DA, Dores GM, et al.: Breast cancer following radiotherapy and chemotherapy among young women with Hodgkin disease. JAMA 290 (4): 465-75, 2003.
- Moskowitz CS, Ronckers CM, Chou JF, et al.: Development and Validation of a Breast Cancer Risk Prediction Model for Childhood Cancer Survivors Treated With Chest Radiation: A Report From the Childhood Cancer Survivor Study and the Dutch Hodgkin Late Effects and LATER Cohorts. J Clin Oncol 39 (27): 3012-3021, 2021.
- Alm El-Din MA, Hughes KS, Finkelstein DM, et al.: Breast cancer after treatment of Hodgkin's lymphoma: risk factors that really matter. Int J Radiat Oncol Biol Phys 73 (1): 69-74, 2009.
- Cooke R, Jones ME, Cunningham D, et al.: Breast cancer risk following Hodgkin lymphoma radiotherapy in relation to menstrual and reproductive factors. Br J Cancer 108 (11): 2399-406, 2013.
- Neppelenbroek SIM, Geurts YM, Aleman BMP, et al.: Doxorubicin Exposure and Breast Cancer Risk in Survivors of Adolescent and Adult Hodgkin Lymphoma. J Clin Oncol 42 (16): 1903-1913, 2024.
- Travis LB, Hill D, Dores GM, et al.: Cumulative absolute breast cancer risk for young women treated for Hodgkin lymphoma. J Natl Cancer Inst 97 (19): 1428-37, 2005.
- Swerdlow AJ, Cooke R, Bates A, et al.: Breast cancer risk after supradiaphragmatic radiotherapy for Hodgkin's lymphoma in England and Wales: a National Cohort Study. J Clin Oncol 30 (22): 2745-52, 2012.
- De Bruin ML, Sparidans J, van't Veer MB, et al.: Breast cancer risk in female survivors of Hodgkin's lymphoma: lower risk after smaller radiation volumes. J Clin Oncol 27 (26): 4239-46, 2009.
- Lavoie JC, Connors JM, Phillips GL, et al.: High-dose chemotherapy and autologous stem cell transplantation for primary refractory or relapsed Hodgkin lymphoma: long-term outcome in the first 100 patients treated in Vancouver. Blood 106 (4): 1473-8, 2005.
- Koontz MZ, Horning SJ, Balise R, et al.: Risk of therapy-related secondary leukemia in Hodgkin lymphoma: the Stanford University experience over three generations of clinical trials. J Clin Oncol 31 (5): 592-8, 2013.
- Valagussa P, Santoro A, Fossati-Bellani F, et al.: Second acute leukemia and other malignancies following treatment for Hodgkin's disease. J Clin Oncol 4 (6): 830-7, 1986.
- Schonfeld SJ, Gilbert ES, Dores GM, et al.: Acute myeloid leukemia following Hodgkin lymphoma: a population-based study of 35,511 patients. J Natl Cancer Inst 98 (3): 215-8, 2006.
- Kreissl S, Müller H, Goergen H, et al.: Health-Related Quality of Life in Patients With Hodgkin Lymphoma: A Longitudinal Analysis of the German Hodgkin Study Group. J Clin Oncol 38 (25): 2839-2848, 2020.
- Dores GM, Curtis RE, Dalal NH, et al.: Cause-Specific Mortality Following Initial Chemotherapy in a Population-Based Cohort of Patients With Classical Hodgkin Lymphoma, 2000-2016. J Clin Oncol 38 (35): 4149-4162, 2020.
- Behringer K, Breuer K, Reineke T, et al.: Secondary amenorrhea after Hodgkin's lymphoma is influenced by age at treatment, stage of disease, chemotherapy regimen, and the use of oral contraceptives during therapy: a report from the German Hodgkin's Lymphoma Study Group. J Clin Oncol 23 (30): 7555-64, 2005.
- van der Kaaij MA, Heutte N, Le Stang N, et al.: Gonadal function in males after chemotherapy for early-stage Hodgkin's lymphoma treated in four subsequent trials by the European Organisation for Research and Treatment of Cancer: EORTC Lymphoma Group and the Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 25 (19): 2825-32, 2007.
- Scholz M, Engert A, Franklin J, et al.: Impact of first- and second-line treatment for Hodgkin's lymphoma on the incidence of AML/MDS and NHL--experience of the German Hodgkin's Lymphoma Study Group analyzed by a parametric model of carcinogenesis. Ann Oncol 22 (3): 681-8, 2011.
- Behringer K, Mueller H, Goergen H, et al.: Gonadal function and fertility in survivors after Hodgkin lymphoma treatment within the German Hodgkin Study Group HD13 to HD15 trials. J Clin Oncol 31 (2): 231-9, 2013.
- Viviani S, Santoro A, Ragni G, et al.: Pre- and post-treatment testicular dysfunction in Hodgkin's disease (HD). [Abstract] Proceedings of the American Society of Clinical Oncology 7: A-877, 227, 1988.
- van der Kaaij MA, Heutte N, Meijnders P, et al.: Premature ovarian failure and fertility in long-term survivors of Hodgkin's lymphoma: a European Organisation for Research and Treatment of Cancer Lymphoma Group and Groupe d'Etude des Lymphomes de l'Adulte Cohort Study. J Clin Oncol 30 (3): 291-9, 2012.
- Anderson RA, Remedios R, Kirkwood AA, et al.: Determinants of ovarian function after response-adapted therapy in patients with advanced Hodgkin's lymphoma (RATHL): a secondary analysis of a randomised phase 3 trial. Lancet Oncol 19 (10): 1328-1337, 2018.
- Weibull CE, Johansson ALV, Eloranta S, et al.: Contemporarily Treated Patients With Hodgkin Lymphoma Have Childbearing Potential in Line With Matched Comparators. J Clin Oncol 36 (26): 2718-2725, 2018.
- Demeestere I, Racape J, Dechene J, et al.: Gonadal Function Recovery in Patients With Advanced Hodgkin Lymphoma Treated With a PET-Adapted Regimen: Prospective Analysis of a Randomized Phase III Trial (AHL2011). J Clin Oncol 39 (29): 3251-3260, 2021.
- Lambertini M, Demeestere I: Another step towards improving oncofertility counselling of young women with Hodgkin's lymphoma. Lancet Oncol 19 (10): 1264-1266, 2018.
- Øvlisen AK, Jakobsen LH, Eloranta S, et al.: Parenthood Rates and Use of Assisted Reproductive Techniques in Younger Hodgkin Lymphoma Survivors: A Danish Population-Based Study. J Clin Oncol 39 (31): 3463-3472, 2021.
- Tarbell NJ, Thompson L, Mauch P: Thoracic irradiation in Hodgkin's disease: disease control and long-term complications. Int J Radiat Oncol Biol Phys 18 (2): 275-81, 1990.
- Hancock SL, Cox RS, McDougall IR: Thyroid diseases after treatment of Hodgkin's disease. N Engl J Med 325 (9): 599-605, 1991.
- Cella L, Conson M, Caterino M, et al.: Thyroid V30 predicts radiation-induced hypothyroidism in patients treated with sequential chemo-radiotherapy for Hodgkin's lymphoma. Int J Radiat Oncol Biol Phys 82 (5): 1802-8, 2012.
- Reinders JG, Heijmen BJ, Olofsen-van Acht MJ, et al.: Ischemic heart disease after mantlefield irradiation for Hodgkin's disease in long-term follow-up. Radiother Oncol 51 (1): 35-42, 1999.
- Hancock SL, Tucker MA, Hoppe RT: Factors affecting late mortality from heart disease after treatment of Hodgkin's disease. JAMA 270 (16): 1949-55, 1993.
- Heidenreich PA, Schnittger I, Strauss HW, et al.: Screening for coronary artery disease after mediastinal irradiation for Hodgkin's disease. J Clin Oncol 25 (1): 43-9, 2007.
- Dabaja B, Cox JD, Buchholz TA: Radiation therapy can still be used safely in combined modality approaches in patients with Hodgkin's lymphoma. J Clin Oncol 25 (1): 3-5, 2007.
- Swerdlow AJ, Higgins CD, Smith P, et al.: Myocardial infarction mortality risk after treatment for Hodgkin disease: a collaborative British cohort study. J Natl Cancer Inst 99 (3): 206-14, 2007.
- van Nimwegen FA, Schaapveld M, Cutter DJ, et al.: Radiation Dose-Response Relationship for Risk of Coronary Heart Disease in Survivors of Hodgkin Lymphoma. J Clin Oncol 34 (3): 235-43, 2016.
- Maraldo MV, Giusti F, Vogelius IR, et al.: Cardiovascular disease after treatment for Hodgkin's lymphoma: an analysis of nine collaborative EORTC-LYSA trials. Lancet Haematol 2 (11): e492-502, 2015.
- Cutter DJ, Ramroth J, Diez P, et al.: Predicted Risks of Cardiovascular Disease Following Chemotherapy and Radiotherapy in the UK NCRI RAPID Trial of Positron Emission Tomography-Directed Therapy for Early-Stage Hodgkin Lymphoma. J Clin Oncol 39 (32): 3591-3601, 2021.
- de Vries S, Haaksma ML, Jóźwiak K, et al.: Development and Validation of Risk Prediction Models for Coronary Heart Disease and Heart Failure After Treatment for Hodgkin Lymphoma. J Clin Oncol 41 (1): 86-95, 2023.
- van Nimwegen FA, Ntentas G, Darby SC, et al.: Risk of heart failure in survivors of Hodgkin lymphoma: effects of cardiac exposure to radiation and anthracyclines. Blood 129 (16): 2257-2265, 2017.
- Galper SL, Yu JB, Mauch PM, et al.: Clinically significant cardiac disease in patients with Hodgkin lymphoma treated with mediastinal irradiation. Blood 117 (2): 412-8, 2011.
- Horning SJ, Adhikari A, Rizk N, et al.: Effect of treatment for Hodgkin's disease on pulmonary function: results of a prospective study. J Clin Oncol 12 (2): 297-305, 1994.
- Martin WG, Ristow KM, Habermann TM, et al.: Bleomycin pulmonary toxicity has a negative impact on the outcome of patients with Hodgkin's lymphoma. J Clin Oncol 23 (30): 7614-20, 2005.
- Prosnitz LR, Lawson JP, Friedlaender GE, et al.: Avascular necrosis of bone in Hodgkin's disease patients treated with combined modality therapy. Cancer 47 (12): 2793-7, 1981.
- Schimpff SC, O'Connell MJ, Greene WH, et al.: Infections in 92 splenectomized patients with Hodgkin's disease. A clinical review. Am J Med 59 (5): 695-701, 1975.
- Behringer K, Goergen H, Müller H, et al.: Cancer-Related Fatigue in Patients With and Survivors of Hodgkin Lymphoma: The Impact on Treatment Outcome and Social Reintegration. J Clin Oncol 34 (36): 4329-4337, 2016.
- Loge JH, Abrahamsen AF, Ekeberg O, et al.: Hodgkin's disease survivors more fatigued than the general population. J Clin Oncol 17 (1): 253-61, 1999.
- Kreissl S, Mueller H, Goergen H, et al.: Cancer-related fatigue in patients with and survivors of Hodgkin's lymphoma: a longitudinal study of the German Hodgkin Study Group. Lancet Oncol 17 (10): 1453-1462, 2016.
- Williams AM, Mirzaei Salehabadi S, Xing M, et al.: Modifiable risk factors for neurocognitive and psychosocial problems after Hodgkin lymphoma. Blood 139 (20): 3073-3086, 2022.
Clasificación celular del linfoma de Hodgkin
En la actualidad, los patólogos usan la clasificación Revised European-American Lymphoma (REAL) en la versión modificada por la Organización Mundial de la Salud (OMS) para determinar la clasificación histológica del linfoma de Hodgkin (LH).[
Clasificación Revised European-American Lymphoma modificada por la Organización Mundial de la Salud
- Linfoma de Hodgkin clásico
- Linfoma de Hodgkin con esclerosis nodular.
- Linfoma de Hodgkin con celularidad mixta.
- Linfoma de Hodgkin con agotamiento linfocítico. De 10 019 pacientes sometidos a una revisión patológica central por expertos del German Hodgkin Study Group, 84 (<1 %) tenían LH clásico con agotamiento linfocítico.[
33 ] Con frecuencia el cuadro clínico inicial de estos pacientes fue de un LH en estadio avanzado consíntomas Bsíntomas B . - Linfoma de Hodgkin clásico rico en linfocitos.
- Linfoma de Hodgkin con predominio linfocítico nodular (LHPLN). Este tipo de linfoma es una entidad clínico-patológica con origen en las células B que se diferencia del LH clásico.[
44 ,55 ]El inmunofenotipo típico del LH clásico es CD15+, CD20-, CD30+, CD45-, mientras que el perfil de la enfermedad con predominio linfocítico es CD15-, CD20+, CD30-, CD45+.
Referencias:
- Lukes RJ, Craver LF, Hall TC, et al.: Report of the Nomenclature Committee. Cancer Res 26 (1): 1311, 1966.
- Harris NL: Hodgkin's lymphomas: classification, diagnosis, and grading. Semin Hematol 36 (3): 220-32, 1999.
- Klimm B, Franklin J, Stein H, et al.: Lymphocyte-depleted classical Hodgkin's lymphoma: a comprehensive analysis from the German Hodgkin study group. J Clin Oncol 29 (29): 3914-20, 2011.
- Eichenauer DA, Plütschow A, Fuchs M, et al.: Long-Term Follow-Up of Patients With Nodular Lymphocyte-Predominant Hodgkin Lymphoma Treated in the HD7 to HD15 Trials: A Report From the German Hodgkin Study Group. J Clin Oncol 38 (7): 698-705, 2020.
- Bartlett NL: Treatment of Nodular Lymphocyte Hodgkin Lymphoma: The Goldilocks Principle. J Clin Oncol 38 (7): 662-668, 2020.
Información sobre los estadios del linfoma de Hodgkin
La estadificación clínica de los pacientes con linfoma de Hodgkin (LH) incluye los siguientes procedimientos:
- Examen físico y antecedentes.
- Pruebas de laboratorio (incluso la velocidad de sedimentación).
- Tomografías computarizadas del tórax y la región abdominal y pélvica, con tomografía por emisión de positrones (TEP) o sin esta.[
11 ] Las TEP combinadas con TC son ahora las imágenes estándar para la estadificación clínica.[22 ]
Ya no se recomienda la laparotomía de estadificación, y se debe tener en cuenta solo cuando los resultados permitan una reducción considerable del tratamiento. No se debe realizar una laparotomía de estadificación en los pacientes que necesitan quimioterapia. Si se necesita una laparotomía para tomar decisiones con respecto al tratamiento, se deben considerar los posibles riesgos de morbilidad.[
En un 5 % de los pacientes se produce compromiso de la médula ósea y este es más prevalente en presencia de
En la reunión de Cotswolds, se definió la enfermedad mediastínica masiva como un índice torácico del 33 % o más para la relación entre el diámetro transversal máximo de la masa y el diámetro transversal interno del tórax medido a la altura del disco intervertebral T5/6 en la radiografía de tórax.[
Sistema de estadificación en subtipos
Clasificación de Lugano
El American Joint Committee on Cancer (AJCC) adoptó la clasificación de Lugano para evaluar y estadificar el linfoma.[
| Estadio | Descripción del estadio | Imagen |
|---|---|---|
| LCR = líquido cefalorraquídeo; LDCBG = linfoma difuso de células B grandes; LNH = linfoma no Hodgkin; TC = tomografía computarizada. | ||
| a Hodgkin and Non-Hodgkin Lymphomas. En: Amin MB, Edge SB, Greene FL, et al., eds.:AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 937–58. | ||
| b Es posible que el estadio II con masa tumoral voluminosa antes se considerara un estadio temprano o avanzado de acuerdo con las características histológicas del linfoma y los factores pronósticos. | ||
| c La definición de una masa tumoral voluminosa varía de acuerdo con el tipo histológico del linfoma. En la clasificación de Lugano, la masa tumoral voluminosa en el linfoma de Hodgkin se define como una masa que mide más de un tercio del diámetro torácico en la TC del tórax, o una masa que mide >10 cm. Las definiciones recomendadas para la masa tumoral voluminosa en el LNH varían de acuerdo con el tipo histológico del linfoma. En el linfoma folicular, se sugirió la medida de 6 cm a partir de la validación del Follicular Lymphoma International Prognostic Index-2. En el LDCBG, se han usado límites que oscilan entre 5 y 10 cm, si bien se recomienda el límite de 10 cm. | ||
| Estadio limitado | ||
| I | Compromiso en un solo sitio linfático (es decir, región ganglionar, anillo de Waldeyer, timo o bazo). | 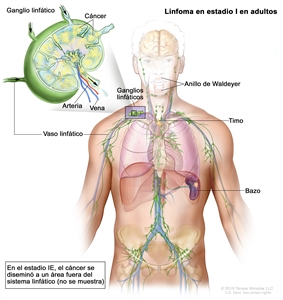 |
| IE | Compromiso de 1 solo sitio extralinfático sin compromiso ganglionar (infrecuente en el linfoma de Hodgkin). | |
| II | Compromiso de 2 o más regiones ganglionares en el mismo lado del diafragma. | 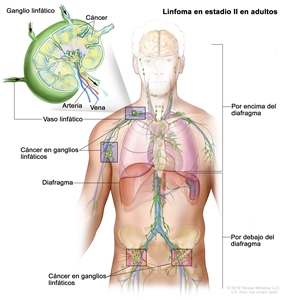 |
| IIE | Diseminación contigua extralinfática desde un sitio ganglionar, con compromiso de otras regiones ganglionares en el mismo lado del diafragma, o sin esta. | 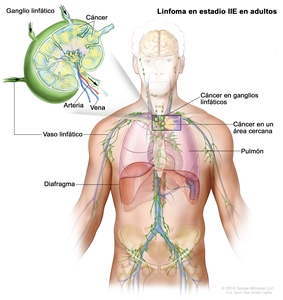 |
| II con masa voluminosab | Estadio II con una gran masa tumoral.c | |
| Estadio avanzado | ||
| III | Compromiso de regiones ganglionares en ambos lados del diafragma; ganglios supradiafragmáticos y compromiso esplénico. | 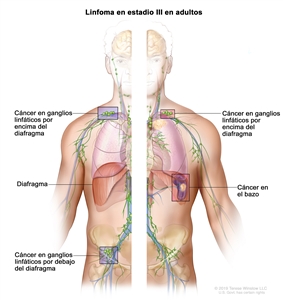 |
| IV | Compromiso difuso o diseminado de uno o más órganos extralinfáticos con compromiso ganglionar relacionado o sin este; compromiso de órgano extralinfático no contiguo con enfermedad ganglionar en estadio II; o compromiso de cualquier órgano extralinfático con enfermedad ganglionar en estadio III. El estadio IV incluye cualquier compromiso del LCR, la médula ósea y el hígado, o la presencia de lesiones pulmonares múltiples (diferentes a las lesiones por diseminación directa en una enfermedad en estadio IIE). | 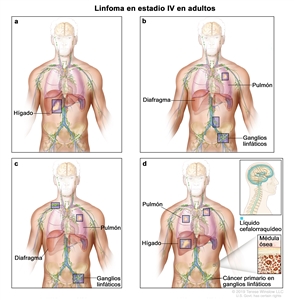 |
| Nota: Se utiliza la designación A o B junto con el grupo de estadio para el linfoma de Hodgkin. Ya no se utiliza la designación A o B para el LNH. | ||
La designación E se usa cuando las neoplasias linfoides extraganglionares malignas surgen o se diseminan a tejidos separados de los conglomerados linfáticos principales pero cercanos a estos. El estadio IV se refiere a la enfermedad con diseminación difusa en un sitio extraganglionar, como el hígado. Si el compromiso de uno o más sitios extralinfáticos se documentó mediante estudio patológico, se usa el símbolo del sitio comprometido seguido por el signo más (+).
| N = ganglios | H = hígado | L = pulmón | M = médula ósea |
| S = bazo | P = pleura | O = hueso | D = piel |
Grupos pronósticos
Múltiples investigadores en muchos ensayos clínicos nuevos emplean un sistema de estadificación clínica que divide a los pacientes en tres grupos principales que también resultan útiles para el médico:[
- En estadio temprano favorable.
- En estadio temprano desfavorable.
- En estadio avanzado.
La asignación al grupo depende de los siguientes aspectos:
| Si el paciente tiene una enfermedad temprana o avanzada. |
| El tipo y el número de factores de pronóstico adverso. |
Factores de pronóstico adverso para la enfermedad en estadio temprano:
- Masa mediastínica grande (>33 % del ancho torácico en la radiografía de tórax, ≥10 cm en una TC).
- Compromiso extraganglionar.
- Velocidad de sedimentación de eritrocitos elevada (>30 mm/h para el
estadio B [según los síntomas]estadio B [según los síntomas] , >50 mm/h para elestadio A [según los síntomas]estadio A [según los síntomas] ). - Compromiso de 3 o más áreas ganglionares.
- Presencia de
síntomas Bsíntomas B .
Grupo en estadio temprano favorable: estadio clínico I o II, sin ninguno de los factores pronósticos citados antes.
Grupo en estadio temprano desfavorable: estadio clínico I o II, con uno o más de los factores pronósticos citados antes.
Factores de pronóstico adverso para el estadio avanzado:
En el International Prognostic Factors Project on Advanced Hodgkin's Disease se formuló un índice pronóstico internacional para los pacientes con LH en estadio avanzado, este puntaje pronóstico se obtiene a partir de los siguientes 7 factores de pronóstico adverso:[
- Concentración de albúmina inferior a 40 g/l.
- Concentración de hemoglobina inferior a 105 g/l.
- Sexo masculino.
- Edad mayor de 45 años.
- Enfermedad en estadio IV.
- Recuento de leucocitos de 15 × 109 /l o más alto.
- Recuento absoluto de linfocitos inferior a 0,6 × 109 /l o recuento de linfocitos superior al 8 % del recuento leucocitario total.
Grupo en estadio avanzado: estadio clínico III o IV con un máximo de 3 de los factores de riesgo adverso citados antes. Los pacientes con enfermedad avanzada tienen una tasa de probabilidad del 60 % al 80 % de que su enfermedad no progrese 5 años después de someterse a quimioterapia de primera línea.[
Referencias:
- Lister TA, Crowther D, Sutcliffe SB, et al.: Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 7 (11): 1630-6, 1989.
- Barrington SF, Kirkwood AA, Franceschetto A, et al.: PET-CT for staging and early response: results from the Response-Adapted Therapy in Advanced Hodgkin Lymphoma study. Blood 127 (12): 1531-8, 2016.
- Urba WJ, Longo DL: Hodgkin's disease. N Engl J Med 326 (10): 678-87, 1992.
- Sombeck MD, Mendenhall NP, Kaude JV, et al.: Correlation of lymphangiography, computed tomography, and laparotomy in the staging of Hodgkin's disease. Int J Radiat Oncol Biol Phys 25 (3): 425-9, 1993.
- Mauch P, Larson D, Osteen R, et al.: Prognostic factors for positive surgical staging in patients with Hodgkin's disease. J Clin Oncol 8 (2): 257-65, 1990.
- Dietrich PY, Henry-Amar M, Cosset JM, et al.: Second primary cancers in patients continuously disease-free from Hodgkin's disease: a protective role for the spleen? Blood 84 (4): 1209-15, 1994.
- Adams HJ, Kwee TC, de Keizer B, et al.: Systematic review and meta-analysis on the diagnostic performance of FDG-PET/CT in detecting bone marrow involvement in newly diagnosed Hodgkin lymphoma: is bone marrow biopsy still necessary? Ann Oncol 25 (5): 921-7, 2014.
- Bradley AJ, Carrington BM, Lawrance JA, et al.: Assessment and significance of mediastinal bulk in Hodgkin's disease: comparison between computed tomography and chest radiography. J Clin Oncol 17 (8): 2493-8, 1999.
- Mauch P, Goodman R, Hellman S: The significance of mediastinal involvement in early stage Hodgkin's disease. Cancer 42 (3): 1039-45, 1978.
- Hodgkin and non-Hodgkin lymphoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 937–58.
- Carbone PP, Kaplan HS, Musshoff K, et al.: Report of the Committee on Hodgkin's Disease Staging Classification. Cancer Res 31 (11): 1860-1, 1971.
- Jost LM, Stahel RA; ESMO Guidelines Task Force: ESMO Minimum Clinical Recommendations for diagnosis, treatment and follow-up of Hodgkin's disease. Ann Oncol 16 (Suppl 1): i54-5, 2005.
- Hasenclever D, Diehl V: A prognostic score for advanced Hodgkin's disease. International Prognostic Factors Project on Advanced Hodgkin's Disease. N Engl J Med 339 (21): 1506-14, 1998.
- Rodday AM, Parsons SK, Upshaw JN, et al.: The Advanced-Stage Hodgkin Lymphoma International Prognostic Index: Development and Validation of a Clinical Prediction Model From the HoLISTIC Consortium. J Clin Oncol 41 (11): 2076-2086, 2023.
Aspectos generales de las opciones de tratamiento del linfoma de Hodgkin
Después de la estadificación inicial del linfoma de Hodgkin (LH), los pacientes con enfermedad temprana favorable o enfermedad temprana desfavorable se tratan con quimioterapia de doxorrubicina, bleomicina, vinblastina y dacarbazina (ABVD) y radiación dirigida al campo comprometido o sin esta, o radiación ganglionar.
Los pacientes con enfermedad en estadio avanzado se tratan en primer lugar con quimioterapia sola, aunque a veces se administra después radioterapia para la enfermedad con gran masa tumoral inicial (masa mediastínica que mide ≥10 cm) o para la adenopatía residual (>2,5 cm) que muestran compromiso en una tomografía por emisión de positrones (TEP) tomada después de la quimioterapia.[
Es posible que los pacientes de LH mayores de 60 años presenten más morbilidad y mortalidad relacionadas con el tratamiento; en ocasiones, es difícil mantener la intensidad de la dosis de la quimioterapia estándar.[
| Grupo pronóstico | Opciones de tratamiento |
|---|---|
| Linfoma de Hodgkin clásico en estadio temprano favorable | |
| Linfoma de Hodgkin clásico en estadio temprano desfavorable | |
| Linfoma de Hodgkin clásico en estadio avanzado | |
| Linfoma de Hodgkin clásico recidivante | |
| |
|
| |
|
| |
|
| |
|
| |
|
| Linfoma de Hodgkin con predominio linfocítico nodular | |
| |
|
| |
|
| |
Quimioterapia
En el Cuadro 4 se describen los regímenes de quimioterapia utilizados para el tratamiento del LH.
| Nombre de la combinación | Fármacos incluidos | Grupo pronóstico |
|---|---|---|
| ABVD | Doxorrubicina, bleomicina, vinblastina y dacarbazina | |
| |
||
| |
||
| BEACOPP | Bleomicina, etopósido, doxorrubicina, ciclofosfamida, vincristina, procarbazina y prednisona | |
| |
||
| GVD | Gemcitabina, vinorelbina y doxorrubicina liposomal | |
| ICE | Ifosfamida, carboplatino y etopósido | |
| MOPP | Mecloretamina, vincristina, procarbazina y prednisona | |
| LH = linfoma de Hodgkin. | ||
Radioterapia
La radioterapia sola casi nunca se usa para tratar a pacientes con LH clásico en estadio temprano favorable de diagnóstico reciente.[
Referencias:
- Engert A, Haverkamp H, Kobe C, et al.: Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin's lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet 379 (9828): 1791-9, 2012.
- Böll B, Görgen H, Fuchs M, et al.: ABVD in older patients with early-stage Hodgkin lymphoma treated within the German Hodgkin Study Group HD10 and HD11 trials. J Clin Oncol 31 (12): 1522-9, 2013.
- Evens AM, Hong F: How can outcomes be improved for older patients with Hodgkin lymphoma? J Clin Oncol 31 (12): 1502-5, 2013.
- Kolstad A, Nome O, Delabie J, et al.: Standard CHOP-21 as first line therapy for elderly patients with Hodgkin's lymphoma. Leuk Lymphoma 48 (3): 570-6, 2007.
- Forero-Torres A, Holkova B, Goldschmidt J, et al.: Phase 2 study of frontline brentuximab vedotin monotherapy in Hodgkin lymphoma patients aged 60 years and older. Blood 126 (26): 2798-804, 2015.
- Friedberg JW, Forero-Torres A, Bordoni RE, et al.: Frontline brentuximab vedotin in combination with dacarbazine or bendamustine in patients aged ≥60 years with HL. Blood 130 (26): 2829-2837, 2017.
- Evens AM, Advani RH, Helenowski IB, et al.: Multicenter Phase II Study of Sequential Brentuximab Vedotin and Doxorubicin, Vinblastine, and Dacarbazine Chemotherapy for Older Patients With Untreated Classical Hodgkin Lymphoma. J Clin Oncol 36 (30): 3015-3022, 2018.
- Böll B, Goergen H, Behringer K, et al.: Bleomycin in older early-stage favorable Hodgkin lymphoma patients: analysis of the German Hodgkin Study Group (GHSG) HD10 and HD13 trials. Blood 127 (18): 2189-92, 2016.
- Herst J, Crump M, Baldassarre FG, et al.: Management of Early-stage Hodgkin Lymphoma: A Practice Guideline. Clin Oncol (R Coll Radiol) 29 (1): e5-e12, 2017.
- Dühmke E, Franklin J, Pfreundschuh M, et al.: Low-dose radiation is sufficient for the noninvolved extended-field treatment in favorable early-stage Hodgkin's disease: long-term results of a randomized trial of radiotherapy alone. J Clin Oncol 19 (11): 2905-14, 2001.
- Mendenhall NP, Rodrigue LL, Moore-Higgs GJ, et al.: The optimal dose of radiation in Hodgkin's disease: an analysis of clinical and treatment factors affecting in-field disease control. Int J Radiat Oncol Biol Phys 44 (3): 551-61, 1999.
- Dabaja BS, Hoppe BS, Plastaras JP, et al.: Proton therapy for adults with mediastinal lymphomas: the International Lymphoma Radiation Oncology Group guidelines. Blood 132 (16): 1635-1646, 2018.
Tratamiento del linfoma de Hodgkin clásico en estadio temprano favorable
Se determina que los pacientes tienen linfoma de Hodgkin (LH) en estadio temprano favorable si presentan una enfermedad en estadio clínico I o II, y no tienen ninguno de los siguientes factores de pronóstico adverso:
- Síntomas B (fiebre sin causa aparente ≥38 °C, sudores nocturnos copiosos, pérdida del peso corporal sin causa aparente en los 6 meses previos ≥10 %).
- Enfermedad extraganglionar.
- Enfermedad con gran masa tumoral (≥10 cm o >33 % del diámetro torácico en la radiografía de tórax).
- Tres o más sitios de compromiso ganglionar.
- Velocidad de sedimentación de 50 mm/h o más.
Opciones de tratamiento del linfoma de Hodgkin clásico en estadio temprano favorable
La opción de tratamiento del linfoma de Hodgkin clásico en estadio temprano favorable es la siguiente:
-
Quimioterapia con radioterapia o sin estaQuimioterapia con radioterapia o sin esta .
Quimioterapia con radioterapia o sin esta
Las opciones de tratamiento son las siguientes:
- Doxorrubicina, bleomicina, vinblastina y dacarbazina (ABVD) durante 3 a 6 ciclos.[
11 ] - ABVD durante 2 a 4 ciclos, radioterapia dirigida al campo comprometido (RTCC) (20 o 30 Gy).
- En determinadas circunstancias, se usa radioterapia sola (como en el caso de adultos mayores con contraindicaciones absolutas para la administración de quimioterapia).[
22 ,33 ]
Tradicionalmente, el tratamiento primario de los pacientes con LH clásico en estadio temprano favorable fue radioterapia sola; por lo general, luego de confirmarse un resultado negativo en la laparotomía de estadificación.
La mortalidad tardía a causa de tumores sólidos (sobre todo, en pulmón, mama, tubo digestivo y tejido conjuntivo) y enfermedad cardiovascular, hacen que la radioterapia sea una opción menos atractiva para los pacientes de riesgo bajo, quienes tienen la mayor probabilidad de cura y supervivencia a largo plazo.[
Evidencia (quimioterapia o radioterapia):
Para los pacientes de LH clásico en estadio temprano favorable, en los siguientes 4 ensayos se estableció el régimen ABVD solo durante 4 ciclos, o el régimen ABVD durante 2 ciclos con 20 Gy de RTCC.
- En un ensayo prospectivo aleatorizado del National Cancer Institute of Canada con 123 pacientes de LH clásico en estadio temprano favorable, se comparó la administración de ABVD durante 4 a 6 ciclos y la radiación ganglionar subtotal.[
99 ][Nivel de evidencia A1]- Después de una mediana de seguimiento de 11,3 años, no se observaron diferencias en las tasas de supervivencia sin complicaciones (89 % vs. 86 %; P = 0,64) ni en las tasas de supervivencia general (SG) (98 % vs. 98 %; P = 0,95).
- En un estudio aleatorizado del Milan Cancer Institute con pacientes de LH en estadio clínico temprano, se comparó la administración de 4 meses de ABVD seguida de RTCC y 4 meses de ABVD seguida de radioterapia de campo extendido (RTCE).[
1010 ][Nivel de evidencia B1]- En los resultados se observaron semejanzas en la SG y la supervivencia sin progresión de la enfermedad después de una mediana de seguimiento de 10 años, pero el estudio tuvo una potencia estadística inadecuada para determinar la ausencia de inferioridad de la RTCC versus la RTCE.
- En el ensayo HD10 del German Hodgkin Study Group (GHSG), se asignó al azar a 1190 pacientes de LH en estadio temprano favorable a uno de los siguientes grupos:[
1111 ,1212 ][Nivel de evidencia A1]- 2 ciclos de ABVD y 30 Gy de RTCC.
- 2 ciclos de ABVD y 20 Gy de RTCC.
- 4 ciclos de ABVD y 30 Gy de RTCC.
- 4 ciclos de ABVD y 20 Gy de RTCC.
En el ensayo se observaron los siguientes resultados:
- Al cabo de una mediana de seguimiento de 8,2 años, no se observaron diferencias (cociente de riesgos instantáneos [CRI], 1,0; intervalo de confianza [IC] 95 %, 0,6–1,5) en las tasas de supervivencia sin progresión de la enfermedad (SSP) a 10 años (87 %) o las tasas de SG (94 %) de los 4 grupos.
- En un estudio de seguimiento de GHSG (ensayo HD13) con 1502 pacientes de LH en estadio temprano favorable que recibieron 30 Gy de radioterapia, se compararon versiones modificadas de ABVD con eliminación de dacarbazina, eliminación de bleomicina o eliminación de ambos fármacos.[
1313 ]- Después de 5 años, el período sin fracaso terapéutico fue significativamente más precario cuando se eliminó la dacarbazina, la bleomicina o ambos fármacos.
- En este ensayo se indica que ABVD sigue siendo el régimen de quimioterapia estándar.
En otros ensayos se investigó la función de la tomografía por emisión de positrones (TEP) para el LH en estadio temprano favorable.
- En tres ensayos prospectivos aleatorizados (EORTC/LYSA/FIL H10 [NCT00433433][
1414 ,1515 ]; RAPID [NCT00943423][1616 ,1717 ] y GHSG HD16 [NCT00736320][1818 ]) de 2889 pacientes con enfermedad en estadio temprano, se investigó el uso de TEP con tomografía computarizada (TEP-TC) para modificar el tratamiento.[1414 ,1515 ,1616 ,1717 ,1818 ]- En los pacientes con LH en estadio temprano favorable que obtuvieron un resultado negativo en la TEP-TC (puntaje de Deauville de 1 o 2), después de 2 o 3 ciclos de ABVD, se pudo omitir la radioterapia sin reducciones significativas en la SG en los tres ensayos.[
1414 ,1616 ,1818 ][Nivel de evidencia B1]Sin embargo, en dos de los ensayos se observó un aumento del riesgo de recaída cuando se omitió la radioterapia. En el ensayo GHSG HD16, para los 628 pacientes con resultado negativo de la enfermedad en la TEP2 (TEP después de dos ciclos de ABVD), la tasa de SSP a 5 años fue del 93,4 % (IC 95 %, 90,4–96,5 %) con la terapia de modalidad combinada y del 86,1 % (IC 95 %, 81,4–90,0 %) con ABVD solo (CRI, 1,78; IC 95 %, 1,02–3,12).[
1818 ] En un análisis subsecuente del ensayo GHSG HD16, se observó que la mayoría de las recidivas se presentaron en el campo de radiación propuesto.[1515 ] En el ensayo EORTC/LYSA/FIL H10, la tasa de SSP a 10 años fue del 98,8 % con 3 ciclos de ABVD y radioterapia y del 85,4 % con 4 ciclos de ABVD sin radioterapia (CRI, 13,2; IC 95 %, 3,1–55,8; P < 0,001).[1717 ]En resumen, esta diferencia del 7 % al 13 % en la SSP sin ninguna diferencia en la SG puede interpretarse como una exigencia para el uso combinado de radioterapia con ABVD con el fin de evitar recidivas, o como una justificación para administrar 4 o más ciclos de AVBD cuando se omite la radioterapia.
- En el estudio RAPID se administró ABVD durante 3 ciclos (6 dosis),[
1616 ] en el estudio EORTC/LYSA/FIL H10 se administró ABVD durante 4 ciclos (8 dosis),[1414 ] y en el estudio GHSG HD16 se administró ABVD durante 2 ciclos (4 dosis).[1818 ] En todos los casos se administró sin radioterapia. - En ninguno de los estudios se usó una asignación aleatorizada al tratamiento cuando los pacientes obtenían un resultado positivo en una TEP-TC intermedia (puntaje de Deauville de 3, 4 o 5) después de 2 o 3 ciclos de ABVD porque esto se produjo en solo el 15 % al 25 % de los pacientes. En uno de los estudios (RAPID) se añadió un ciclo adicional de ABVD y 30 Gy de RTCC,[
1616 ] en otro estudio (EORTC H10F) se cambió a una terapia intensificada con bleomicina, etopósido, doxorrubicina, ciclofosfamida, vincristina, procarbazina y prednisona (BEACOPP) durante 2 ciclos además de 30 Gy de radioterapia dirigida al compromiso ganglionar[1414 ], y en el otro estudio (GHSG HD16) se añadió RTCC en dosis de 30 Gy.[1818 ]En el estudio RAPID (NCT00943423), los pacientes con puntajes de Deauville de 5 (captación ≥3 veces la captación máxima del hígado) en las TEP-TC posquimioterapia tuvieron tasas inferiores de SSP a 5 años (61,9 %; IC 95 %, 41,1–82,7 %) y de SG a 5 años (85,2 %; IC 95 %, 69,7–100 %) (P = 0,002) cuando se los comparó con pacientes que presentaban puntajes de Deauville de 1 a 4 (P < 0,001).[
1919 ]
- En los pacientes con LH en estadio temprano favorable que obtuvieron un resultado negativo en la TEP-TC (puntaje de Deauville de 1 o 2), después de 2 o 3 ciclos de ABVD, se pudo omitir la radioterapia sin reducciones significativas en la SG en los tres ensayos.[
También se estudió a pacientes de más edad con LH en estadio temprano favorable.
- En una revisión retrospectiva de toxicidad pulmonar en los ensayos HD10 y HD13, se analizaron datos de 287 pacientes mayores de 60 años con enfermedad temprana favorable y se observaron los siguientes resultados:[
2020 ]- 2 ciclos de ABVD y RTCC (137 pacientes): 2 % de toxicidad pulmonar.
- 2 ciclos de AVD (sin bleomicina) y RTCC (82 pacientes): 2 % de toxicidad pulmonar.
- 4 ciclos de ABVD y RTCC (68 pacientes): 10 % de toxicidad pulmonar.
Para los pacientes de más edad (>60 años) con enfermedad temprana favorable, se puede omitir la bleomicina para evitar la toxicidad pulmonar cuando se necesiten más de 2 ciclos de ABVD.
Resumen de linfoma de Hodgkin clásico en estadio temprano favorable:
- Se recomienda el uso de 3 o 4 ciclos de ABVD solo para pacientes de LH clásico en estadio temprano favorable cuando se obtiene un resultado negativo en la TEP-TC intermedia después de 2 o 3 ciclos de quimioterapia.[
2121 ] Estos pacientes además tienen una probabilidad baja de presentar una recaída, por lo tanto, no se recomienda el uso de TC durante elseguimientoseguimiento . - Cuando se observa positividad en una TEP-TC intermedia, se recomienda el uso de ciclos adicionales de ABVD y radioterapia dirigida al compromiso ganglionar.
- En los pacientes de LH clásico en estadio temprano favorable también se puede utilizar un abordaje de modalidad combinada con 2 ciclos de ABVD y 20 Gy de RTCC.[
2121 ] En este caso, una TEP-TC es suficiente para evaluar la respuesta después de finalizar el tratamiento.
Ensayos clínicos en curso
Realizar una
Referencias:
- Canellos GP, Abramson JS, Fisher DC, et al.: Treatment of favorable, limited-stage Hodgkin's lymphoma with chemotherapy without consolidation by radiation therapy. J Clin Oncol 28 (9): 1611-5, 2010.
- Landgren O, Axdorph U, Fears TR, et al.: A population-based cohort study on early-stage Hodgkin lymphoma treated with radiotherapy alone: with special reference to older patients. Ann Oncol 17 (8): 1290-5, 2006.
- Backstrand KH, Ng AK, Takvorian RW, et al.: Results of a prospective trial of mantle irradiation alone for selected patients with early-stage Hodgkin's disease. J Clin Oncol 19 (3): 736-41, 2001.
- Dores GM, Metayer C, Curtis RE, et al.: Second malignant neoplasms among long-term survivors of Hodgkin's disease: a population-based evaluation over 25 years. J Clin Oncol 20 (16): 3484-94, 2002.
- Reinders JG, Heijmen BJ, Olofsen-van Acht MJ, et al.: Ischemic heart disease after mantlefield irradiation for Hodgkin's disease in long-term follow-up. Radiother Oncol 51 (1): 35-42, 1999.
- Longo DL: Radiation therapy in Hodgkin disease: why risk a Pyrrhic victory? J Natl Cancer Inst 97 (19): 1394-5, 2005.
- Swerdlow AJ, Higgins CD, Smith P, et al.: Myocardial infarction mortality risk after treatment for Hodgkin disease: a collaborative British cohort study. J Natl Cancer Inst 99 (3): 206-14, 2007.
- Engert A, Franklin J, Eich HT, et al.: Two cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine plus extended-field radiotherapy is superior to radiotherapy alone in early favorable Hodgkin's lymphoma: final results of the GHSG HD7 trial. J Clin Oncol 25 (23): 3495-502, 2007.
- Meyer RM, Gospodarowicz MK, Connors JM, et al.: ABVD alone versus radiation-based therapy in limited-stage Hodgkin's lymphoma. N Engl J Med 366 (5): 399-408, 2012.
- Bonadonna G, Bonfante V, Viviani S, et al.: ABVD plus subtotal nodal versus involved-field radiotherapy in early-stage Hodgkin's disease: long-term results. J Clin Oncol 22 (14): 2835-41, 2004.
- Engert A, Plütschow A, Eich HT, et al.: Reduced treatment intensity in patients with early-stage Hodgkin's lymphoma. N Engl J Med 363 (7): 640-52, 2010.
- Sasse S, Bröckelmann PJ, Goergen H, et al.: Long-Term Follow-Up of Contemporary Treatment in Early-Stage Hodgkin Lymphoma: Updated Analyses of the German Hodgkin Study Group HD7, HD8, HD10, and HD11 Trials. J Clin Oncol 35 (18): 1999-2007, 2017.
- Behringer K, Goergen H, Hitz F, et al.: Omission of dacarbazine or bleomycin, or both, from the ABVD regimen in treatment of early-stage favourable Hodgkin's lymphoma (GHSG HD13): an open-label, randomised, non-inferiority trial. Lancet 385 (9976): 1418-27, 2015.
- Raemaekers JM, André MP, Federico M, et al.: Omitting radiotherapy in early positron emission tomography-negative stage I/II Hodgkin lymphoma is associated with an increased risk of early relapse: Clinical results of the preplanned interim analysis of the randomized EORTC/LYSA/FIL H10 trial. J Clin Oncol 32 (12): 1188-94, 2014.
- Baues C, Goergen H, Fuchs M, et al.: Involved-Field Radiation Therapy Prevents Recurrences in the Early Stages of Hodgkin Lymphoma in PET-Negative Patients After ABVD Chemotherapy: Relapse Analysis of GHSG Phase 3 HD16 Trial. Int J Radiat Oncol Biol Phys 111 (4): 900-906, 2021.
- Radford J, Illidge T, Counsell N, et al.: Results of a trial of PET-directed therapy for early-stage Hodgkin's lymphoma. N Engl J Med 372 (17): 1598-607, 2015.
- Federico M, Fortpied C, Stepanishyna Y, et al.: Long-Term Follow-Up of the Response-Adapted Intergroup EORTC/LYSA/FIL H10 Trial for Localized Hodgkin Lymphoma. J Clin Oncol 42 (1): 19-25, 2024.
- Fuchs M, Goergen H, Kobe C, et al.: Positron Emission Tomography-Guided Treatment in Early-Stage Favorable Hodgkin Lymphoma: Final Results of the International, Randomized Phase III HD16 Trial by the German Hodgkin Study Group. J Clin Oncol 37 (31): 2835-2845, 2019.
- Barrington SF, Phillips EH, Counsell N, et al.: Positron Emission Tomography Score Has Greater Prognostic Significance Than Pretreatment Risk Stratification in Early-Stage Hodgkin Lymphoma in the UK RAPID Study. J Clin Oncol 37 (20): 1732-1741, 2019.
- Böll B, Goergen H, Behringer K, et al.: Bleomycin in older early-stage favorable Hodgkin lymphoma patients: analysis of the German Hodgkin Study Group (GHSG) HD10 and HD13 trials. Blood 127 (18): 2189-92, 2016.
- Bröckelmann PJ, Sasse S, Engert A: Balancing risk and benefit in early-stage classical Hodgkin lymphoma. Blood 131 (15): 1666-1678, 2018.
Tratamiento del linfoma de Hodgkin clásico en estadio temprano desfavorable
Se determina que los pacientes tienen linfoma de Hodgkin (LH) en estadio temprano desfavorable si tienen una enfermedad en estadio clínico I o II, y uno o más de los siguientes factores de riesgo:
- Síntomas B (fiebre sin causa aparente ≥38 °C, sudores nocturnos copiosos, pérdida del peso corporal sin causa aparente en los 6 meses previos ≥10 %).
- Enfermedad extraganglionar.
- Enfermedad con gran masa tumoral (≥10 cm o >33 % del diámetro torácico en la radiografía de tórax).
- Tres o más sitios de compromiso ganglionar.
- Velocidad de sedimentación de 50 mm/h o más.
En una revisión retrospectiva se encontró que la enfermedad en estadio temprano infradiafragmática acarrea un pronóstico inferior en comparación con la enfermedad supradiafragmática, que es más frecuente (>90 %); la disminución de las tasas de supervivencia general (SG) es del 6 % (91,5 % vs. 97,6 %; P < 0,001).[
Opciones de tratamiento del linfoma de Hodgkin clásico en estadio temprano desfavorable
La opción de tratamiento estándar del linfoma de Hodgkin clásico en estadio temprano desfavorable es la siguiente:
-
Quimioterapia con radioterapia o sin estaQuimioterapia con radioterapia o sin esta .
Quimioterapia con radioterapia o sin esta
Las opciones de tratamiento son las siguientes:[
- Cuatro ciclos de doxorrubicina, bleomicina, vinblastina y dacarbazina (ABVD) y radioterapia dirigida al campo comprometido (RTCC) (20 a 30 Gy).[
44 ,55 ,66 ,77 ] - Seis ciclos de ABVD.[
22 ,33 ]
Para obtener una descripción de los regímenes de quimioterapia utilizados para tratar el LH, consultar el
Evidencia (quimioterapia y radioterapia):
- En un ensayo prospectivo aleatorizado del National Cancer Institute of Canada (NCIC) con 276 pacientes de LH en estadio temprano desfavorable, se comparó la administración de 4 a 6 ciclos de ABVD con la administración de 2 ciclos de ABVD y radioterapia de campo extendido (RTCE).[
22 ][Nivel de evidencia A1]- Después de una mediana de seguimiento de 11,3 años, el puntaje de supervivencia sin progresión de la enfermedad favoreció el uso de terapia de modalidad combinada (86 % vs. 94 %; P = 0,006), pero la tasa de SG fue más favorable cuando se usó ABVD solo (92 % vs. 81 %; P = 0,04).
- La tendencia hacia una supervivencia más precaria en el grupo de modalidad combinada se atribuyó a un exceso de segundas neoplasias malignas y muertes por causas cardiovasculares. En este ensayo, se usaron dosis más altas de RTCE y exposiciones mucho más prolongadas de sitios del cuerpo que las que se emplean en la práctica actual.
- En este ensayo, se estableció que se pueden administrar 6 ciclos de ABVD solo, y que es posible que las complicaciones a largo plazo de la radioterapia invaliden las diferencias en la supervivencia sin progresión (SSP).
- En el ensayo HD11 del German Hodgkin Study Group (GHSG), se asignó al azar a 1395 pacientes con LH en estadio temprano desfavorable para recibir uno de los siguientes tratamientos:
- 4 ciclos de ABVD y 30 Gy de RTCC.
- 4 ciclos de ABVD y 20 Gy de RTCC.
- 4 ciclos de bleomicina, etopósido, doxorrubicina, ciclofosfamida, vincristina, procarbazina y prednisona (BEACOPP) y 30 Gy de RTCC.
- 4 ciclos de BEACOPP y 20 Gy de RTCC.
Se observaron los siguientes resultados:
- Después de una mediana de seguimiento de 8,8 años no se observaron diferencias en la tasa de SG (93–96 %) en los 4 grupos.[
88 ][Nivel de evidencia A1] - En los grupos del estudio que recibieron 30 Gy de RTCC, no se encontraron diferencias en el período sin fracaso terapéutico entre BEACOPP y ABVD (P = 0,65); no obstante, cuando se usaron 20 Gy de RTCC, se observaron diferencias significativas en la SSP en contra de ABVD (tasa de SSP a 10 años, 84 % vs. 76 %; cociente de riesgos instantáneos [CRI], 1,5; intervalo de confianza [IC] 95 %, 1,0–2,1).[
55 ][Nivel de evidencia B1] - En este ensayo, se estableció como abordaje preferido la administración de 4 cuatro ciclos de ABVD y 30 Gy de RTCC (o BEACOPP y 20 Gy de RTCC).
- En el ensayo HD14, el GHSG asignó al azar a 1528 pacientes de LH en estadio temprano desfavorable a recibir 4 ciclos de ABVD y 30 Gy de RTCC, o 2 ciclos de BEACOPP intensificados, seguidos de 2 ciclos de ABVD y 30 Gy de RTCC.[
66 ][Nivel de evidencia A1]- Después de una mediana de seguimiento de 43 meses, no se observó diferencia en la SG.
- En este ensayo, se estableció como abordaje preferido la administración de 4 cuatro ciclos de ABVD y 30 Gy de RTCC.
- En el ensayo H9-U del European Organisation for Research and Treatment of Cancer–Groupe d'Étude des Lymphomes de l'Adulte (EORTC/GELA), se asignó al azar a 808 pacientes con enfermedad temprana desfavorable (incluso 40 % con enfermedad con gran masa tumoral) a recibir uno de los siguientes tratamientos [
77 ][Nivel de evidencia A1]:- 6 ciclos de ABVD y 36 Gy de RTCC.
- 4 ciclos de ABVD y 36 Gy de RTCC.
- 4 ciclos de BEACOPP y 36 Gy de RTCC.
Se observaron los siguientes resultados:
- Después de una mediana de seguimiento de 64 meses, no se observaron diferencias (tasas de supervivencia sin complicaciones, 89–92 %; P = 0,38; o tasas de SG (91–96 %; P = 0,89).
- A partir del perfil de toxicidad, se estableció como régimen preferido la administración de 4 ciclos de ABVD y RTCC.
- En un estudio multicéntrico de 117 pacientes (la mayoría de ellos con enfermedad voluminosa) se observó que el tratamiento con 4 ciclos de BV-AVD (brentuximab vedotina con doxorrubicina, vinblastina y dacarbazina), con radioterapia dirigida al sitio comprometido o sin esta, se tolera bien y es eficaz.[
99 ]- Al cabo de una mediana de seguimiento de 3,8 años, la SSP general a 2 años fue del 94 % (IC 95 %, 89,7–98,3 %). La SG a 2 años fue del 99,1 % (97,3–100,0 %).[
99 ][Nivel de evidencia C2] - Este estudio piloto se debe confirmar, pero los resultados quizás sean alentadores para los pacientes que no pueden recibir bleomicina o deben limitar la exposición a las antraciclinas.
- Al cabo de una mediana de seguimiento de 3,8 años, la SSP general a 2 años fue del 94 % (IC 95 %, 89,7–98,3 %). La SG a 2 años fue del 99,1 % (97,3–100,0 %).[
¿Se podría omitir la radioterapia para reducir al mínimo la morbilidad y la mortalidad tardías producidas por segundos tumores sólidos y enfermedad cardiovascular?[
| En el estudio NCIC se abordó esta pregunta con respecto a pacientes con LH en estadio temprano desfavorable. Aunque 4 a 6 ciclos de ABVD sola mejoran la SG en comparación con el abordaje de modalidad combinada, el uso de RTCE en el grupo de modalidad combinada resulta excesivo según los estándares vigentes y los efectos tardíos aumentarán cuando se usan estos campos más amplios.[ |
| En un análisis retrospectivo de 215 pacientes que se trataron con ABVD y radioterapia más contemporánea (20–30 Gy, limitada al campo) se los comparó con una cohorte de 860 personas emparejadas por edad, sexo, región geográfica y enfermedades graves.[ |
En un metanálisis de Cochrane con 1245 pacientes de 5 ensayos clínicos aleatorizados, se indicó una mejora de la supervivencia con la terapia de modalidad combinada versus la quimioterapia sola (CRI, 0,40; IC 95 %, 0,27–0,61).[
En otros ensayos, se investigó la función de la tomografía por emisión de positrones con tomografía computarizada (TEP-TC) para pacientes de LH en estadio temprano desfavorable.
- En un ensayo prospectivo aleatorizado (EORTC HIOU) con 1196 pacientes de LH en estadio temprano desfavorable, se investigó el uso de TEP-TC para modificar el tratamiento después de 2 ciclos de terapia.[
1313 ]- Entre un grupo de 815 pacientes con un resultado negativo en la TEP-TC (puntaje de Deauville de 1 o 2) después de 2 ciclos de ABVD, los pacientes asignados al azar a recibir 6 ciclos de ABVD tuvieron tasas inferiores de SSP en comparación con los pacientes que recibieron 4 ciclos de ABVD y radioterapia dirigida al compromiso ganglionar (94,7 vs. 99,2 %; P = 0,026), pero no hubo diferencia en la SG.[Nivel de evidencia B1]
- El uso de 6 ciclos de ABVD es aceptable si no se administra radioterapia para pacientes de LH clásico en estadio temprano desfavorable con resultado negativo en la TEP-TC después de 2 ciclos de ABVD, cuando se considera admisible un aumento del 5 % en la tasa de recaída, sin disminución en la SG después de la terapia de rescate.
- En un informe de seguimiento de este ensayo, 381 pacientes con resultado positivo en la TEP-TC (puntaje de Deauville de 3, 4 o 5) después de 2 ciclos de ABVD se asignaron al azar a recibir 4 ciclos de ABVD y 30 Gy de radioterapia dirigida al compromiso ganglionar versus 2 ciclos de ABVD seguidos de 2 ciclos de BEACOPP intensificado y 30 Gy de radioterapia dirigida al compromiso ganglionar.[
1414 ][Nivel de evidencia A1]- La tasa de SSP a 5 años fue del 91 % en el grupo de BEACOPP en comparación con el 77 % en el grupo de ABVD (P = 0,002).
- La tasa de SG a 5 años fue del 96 % en el grupo de BEACOPP en comparación con el 89 % en el grupo de ABVD (P = 0,02).
Con este ensayo, se apoya la adición de BEACOPP intensificado al régimen ABVD para los pacientes con LH clásico en estadio temprano desfavorable que obtienen un resultado positivo en la TEP-TC después de 2 ciclos.
- En un ensayo prospectivo aleatorizado (GHSG HD17 [NCT01356680]) de 1100 pacientes con LH desfavorable en estadio temprano se evaluó si la radioterapia se puede omitir en pacientes que presentan respuesta metabólica completa (RMC) en la TEP-TC después de 2 ciclos de BEACOPP intensificado y 2 ciclos de BEACOPP habitual (régimen 2 + 2). Los pacientes se asignaron al azar a recibir la terapia de modalidad combinada (n = 548) o terapia guiada por TEP4 (n = 552). La terapia de modalidad combinada incluyó el régimen 2 + 2 y radioterapia dirigida al campo. La terapia guiada por TEP4 incluyó el régimen 2 + 2 para todos los pacientes con un resultado positivo en la TEP4 (n = 160). En el grupo de terapia guiada por TEP4, un total de 333 pacientes presentaron resultados negativos en la TEP4 y recibieron quimioterapia sola.[
1515 ]- Al cabo de una mediana de seguimiento de 46,2 meses, la tasa de SSP a 5 años fue del 97,3 % (IC 95 %, 94,5–98,7 %) en los pacientes que recibieron terapia de modalidad combinada y del 95,1 % (IC 95 %, 92,0–97,0 %) en los pacientes que recibieron terapia guiada por PET4 (CRI, 0,523; IC 95 %, 0,23–1,21). La diferencia entre los grupos fue del 2,2 % (IC 95 %, -0,9 % a 5,3 %) y excluyó el margen de ausencia de inferioridad del 8 %.[
1515 ][Nivel de evidencia B1] - En el subgrupo de pacientes con resultados negativos en la TEP4 que recibieron quimioterapia sola, la diferencia en la SSP a 5 años fue del 1,7 % (IC 95 %, -1,8 % a 5,3 %).
- La omisión de la radioterapia en los pacientes con RMC después de 4 ciclos de quimioterapia con BEACOPP no perjudicó significativamente la SSP.
- Al cabo de una mediana de seguimiento de 46,2 meses, la tasa de SSP a 5 años fue del 97,3 % (IC 95 %, 94,5–98,7 %) en los pacientes que recibieron terapia de modalidad combinada y del 95,1 % (IC 95 %, 92,0–97,0 %) en los pacientes que recibieron terapia guiada por PET4 (CRI, 0,523; IC 95 %, 0,23–1,21). La diferencia entre los grupos fue del 2,2 % (IC 95 %, -0,9 % a 5,3 %) y excluyó el margen de ausencia de inferioridad del 8 %.[
- En un ensayo prospectivo de fase II participaron 94 pacientes con enfermedad voluminosa en estadio temprano (I/II) (definida como masa >10 cm o >⅓ del diámetro intratorácico máximo en la radiografía de tórax). Los pacientes recibieron ABVD durante 2 ciclos, seguida de una TEP intermedia (TEP2). Los pacientes con TEP negativa (78 % del total) se definieron como Deauville 1, 2 o 3 y recibieron 2 ciclos más de ABVD. Los pacientes con TEP2 positiva (Deauville 4 o 5, 22 % del total) recibieron 4 ciclos de BEACOPP intensificado, seguidos de 30,6 Gy de RTCC.[
1616 ]- Al cabo de una mediana de seguimiento de 60 meses, la tasa de SSP a 3 años fue del 93,1 % en los pacientes con TEP2 negativa y del 89,7 % en los pacientes con TEP2 positiva. La tasa de SG a 3 años fue del 98,6 % en los pacientes con TEP2 negativa y del 94,4 % en los pacientes con TEP2 positiva.[
1616 ][Nivel de evidencia C3]
- Al cabo de una mediana de seguimiento de 60 meses, la tasa de SSP a 3 años fue del 93,1 % en los pacientes con TEP2 negativa y del 89,7 % en los pacientes con TEP2 positiva. La tasa de SG a 3 años fue del 98,6 % en los pacientes con TEP2 negativa y del 94,4 % en los pacientes con TEP2 positiva.[
En resumen:
- En la mayoría de los ensayos, se apoya el uso de 4 ciclos de ABVD y 30 Gy de RTCC o radioterapia dirigida al compromiso ganglionar.[
1717 ] - Una alternativa razonable es la administración de 6 ciclos de ABVD solo, pese a una disminución del 5 % al 6 % en la SSP, porque la toxicidad a largo plazo de la adición de radioterapia afectará la SG, que es el desenlace más importante para el paciente.[
1717 ] - Para pacientes con una TEP-TC positiva (por lo general Deauville 4 o 5) después de 2 ciclos de ABVD, es posible considerar la adición de brentuximab vedotina con la eliminación de bleomicina. En este entorno, se indica BEACOPP, o la participación en ensayos clínicos con adición de brentuximab vedotina o inhibidores de puntos de control.
- Es posible omitir la radioterapia en pacientes con una TEP-TC negativa (Deauville 1) después de 2 a 4 ciclos de quimioterapia.
Los pacientes que tienen una enfermedad con gran masa tumoral (≥10 cm) o compromiso mediastínico masivo se excluyeron de la mayoría de los ensayos mencionados antes. A partir de comparaciones históricas de quimioterapia o radioterapia solas, estos pacientes reciben tratamiento de modalidad combinada.[
Ensayos clínicos en curso
Realizar una
Referencias:
- Sasse S, Goergen H, Plütschow A, et al.: Outcome of Patients With Early-Stage Infradiaphragmatic Hodgkin Lymphoma: A Comprehensive Analysis From the German Hodgkin Study Group. J Clin Oncol 36 (25): 2603-2611, 2018.
- Meyer RM, Gospodarowicz MK, Connors JM, et al.: ABVD alone versus radiation-based therapy in limited-stage Hodgkin's lymphoma. N Engl J Med 366 (5): 399-408, 2012.
- Canellos GP, Abramson JS, Fisher DC, et al.: Treatment of favorable, limited-stage Hodgkin's lymphoma with chemotherapy without consolidation by radiation therapy. J Clin Oncol 28 (9): 1611-5, 2010.
- Gunther JR, Fanale MA, Reddy JP, et al.: Treatment of Early-Stage Unfavorable Hodgkin Lymphoma: Efficacy and Toxicity of 4 Versus 6 Cycles of ABVD Chemotherapy With Radiation. Int J Radiat Oncol Biol Phys 96 (1): 110-8, 2016.
- Eich HT, Diehl V, Görgen H, et al.: Intensified chemotherapy and dose-reduced involved-field radiotherapy in patients with early unfavorable Hodgkin's lymphoma: final analysis of the German Hodgkin Study Group HD11 trial. J Clin Oncol 28 (27): 4199-206, 2010.
- von Tresckow B, Plütschow A, Fuchs M, et al.: Dose-intensification in early unfavorable Hodgkin's lymphoma: final analysis of the German hodgkin study group HD14 trial. J Clin Oncol 30 (9): 907-13, 2012.
- Fermé C, Thomas J, Brice P, et al.: ABVD or BEACOPPbaseline along with involved-field radiotherapy in early-stage Hodgkin Lymphoma with risk factors: Results of the European Organisation for Research and Treatment of Cancer (EORTC)-Groupe d'Étude des Lymphomes de l'Adulte (GELA) H9-U intergroup randomised trial. Eur J Cancer 81: 45-55, 2017.
- Sasse S, Bröckelmann PJ, Goergen H, et al.: Long-Term Follow-Up of Contemporary Treatment in Early-Stage Hodgkin Lymphoma: Updated Analyses of the German Hodgkin Study Group HD7, HD8, HD10, and HD11 Trials. J Clin Oncol 35 (18): 1999-2007, 2017.
- Kumar A, Casulo C, Advani RH, et al.: Brentuximab Vedotin Combined With Chemotherapy in Patients With Newly Diagnosed Early-Stage, Unfavorable-Risk Hodgkin Lymphoma. J Clin Oncol 39 (20): 2257-2265, 2021.
- Meyer RM, Hoppe RT: Point/counterpoint: early-stage Hodgkin lymphoma and the role of radiation therapy. Blood 120 (23): 4488-95, 2012.
- Lagerlöf I, Fohlin H, Enblad G, et al.: Limited, But Not Eliminated, Excess Long-Term Morbidity in Stage I-IIA Hodgkin Lymphoma Treated With Doxorubicin, Bleomycin, Vinblastine, and Dacarbazine and Limited-Field Radiotherapy. J Clin Oncol 40 (13): 1487-1496, 2022.
- Herbst C, Rehan FA, Skoetz N, et al.: Chemotherapy alone versus chemotherapy plus radiotherapy for early stage Hodgkin lymphoma. Cochrane Database Syst Rev (2): CD007110, 2011.
- Raemaekers JM, André MP, Federico M, et al.: Omitting radiotherapy in early positron emission tomography-negative stage I/II Hodgkin lymphoma is associated with an increased risk of early relapse: Clinical results of the preplanned interim analysis of the randomized EORTC/LYSA/FIL H10 trial. J Clin Oncol 32 (12): 1188-94, 2014.
- André MPE, Girinsky T, Federico M, et al.: Early Positron Emission Tomography Response-Adapted Treatment in Stage I and II Hodgkin Lymphoma: Final Results of the Randomized EORTC/LYSA/FIL H10 Trial. J Clin Oncol 35 (16): 1786-1794, 2017.
- Borchmann P, Plütschow A, Kobe C, et al.: PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma (GHSG HD17): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 22 (2): 223-234, 2021.
- LaCasce AS, Dockter T, Ruppert AS, et al.: Positron Emission Tomography-Adapted Therapy in Bulky Stage I/II Classic Hodgkin Lymphoma: CALGB 50801 (Alliance). J Clin Oncol 41 (5): 1023-1034, 2023.
- Bröckelmann PJ, Sasse S, Engert A: Balancing risk and benefit in early-stage classical Hodgkin lymphoma. Blood 131 (15): 1666-1678, 2018.
- Longo DL, Glatstein E, Duffey PL, et al.: Alternating MOPP and ABVD chemotherapy plus mantle-field radiation therapy in patients with massive mediastinal Hodgkin's disease. J Clin Oncol 15 (11): 3338-46, 1997.
- Horning SJ, Hoppe RT, Breslin S, et al.: Stanford V and radiotherapy for locally extensive and advanced Hodgkin's disease: mature results of a prospective clinical trial. J Clin Oncol 20 (3): 630-7, 2002.
- Advani RH, Hong F, Fisher RI, et al.: Randomized Phase III Trial Comparing ABVD Plus Radiotherapy With the Stanford V Regimen in Patients With Stages I or II Locally Extensive, Bulky Mediastinal Hodgkin Lymphoma: A Subset Analysis of the North American Intergroup E2496 Trial. J Clin Oncol 33 (17): 1936-42, 2015.
- Savage KJ: Advanced stage classical Hodgkin lymphoma patients with a negative PET-scan following treatment with ABVD have excellent outcomes without the need for consolidative radiotherapy regardless of disease bulk at presentation. [Abstract] Blood 126 (23): 579, 2015.
Tratamiento del linfoma de Hodgkin clásico en estadio avanzado
En el International Prognostic Score para el linfoma de Hodgkin (LH) clásico en estadio avanzado, se combinaron los siguientes factores de pronóstico adverso:[
- Concentración de albúmina inferior a 40 g/l.
- Concentración de hemoglobina inferior a 105 g/l.
- Sexo masculino.
- 45 años o más.
- Enfermedad en estadio IV.
- Recuento de leucocitos de 15 × 109 /l o más alto.
- Recuento absoluto de linfocitos inferior a 0,6 × 109 /l o un recuento de linfocitos superior al 8 % del recuento leucocitario total.
| Número de factores de riesgo | SSP a 5 años (%) | SG a 5 años (%) |
|---|---|---|
| SSP = supervivencia sin progresión; SG = supervivencia general. | ||
| 0 | 88 | 98 |
| 1 | 84 | 97 |
| 2 | 80 | 92 |
| 3 | 74 | 91 |
| 4 | 67 | 88 |
| ≥5 | 62 | 73 |
Incluso los pacientes con el riesgo más alto según este índice tienen una tasa de supervivencia sin progresión a 5 años superior al 60 % y una tasa de supervivencia general (SG) a 5 años superior al 70 %.[
Opciones de tratamiento del linfoma de Hodgkin clásico en estadio avanzado
La opción de tratamiento del linfoma de Hodgkin clásico en estadio avanzado es la siguiente:
-
Quimioterapia con o sin inmunoterapia o conjugados fármaco-anticuerpoQuimioterapia con o sin inmunoterapia o conjugados fármaco-anticuerpo .- N-AVD (nivolumab [un inhibidor de puntos de control] con doxorrubicina, vinblastina y dacarbazina).
- BV-AVD (brentuximab vedotina [un conjugado anticuerpo-fármaco dirigido contra CD30] con doxorrubicina, vinblastina y dacarbazina).
- ABVD (doxorrubicina, bleomicina, vinblastina y dacarbazina).
Quimioterapia con o sin nivolumab o brentuximab vedotina
Los regímenes de quimioterapia N-AVD y BV-AVD se administran durante 6 ciclos. Estos regímenes han reemplazado a ABVD, régimen que fue el estándar anterior durante 3 décadas.[
Para obtener una descripción de los regímenes de quimioterapia utilizados para tratar el LH, consultar el
Evidencia (quimioterapia con o sin nivolumab o brentuximab vedotina):
- En un ensayo aleatorizado prospectivo(NCT03907488) se incluyeron 994 pacientes con LH en estadio avanzado no tratado. En este estudio se comparó el régimen N-AVD con el régimen BV-AVD.[
44 ]- Al cabo de una mediana de seguimiento de 2,1 años, la tasa de supervivencia sin progresión (SSP) a 2 años del 92 % (intervalo de confianza [IC] 95 %, 89–94 %) favoreció al régimen N-AVD sobre el régimen BV-AVD cuya tasa fue de 83 % (IC 95 %, 79–86 %) (cociente de riesgos instantáneos [CRI], 0,45; IC 95 %, 0,30–0,65; P = 0,001).[
44 ][Nivel de evidencia B1] - La probabilidad de interrupción del tratamiento debido a efectos secundarios fue del doble en los pacientes que recibieron BV-AVD (22 vs. 11 %), sobre todo por neuropatía sensorial periférica. La neuropatía sensorial periférica de grado 2 o superior se presentó en el 32 % de los pacientes que recibieron BV-AVD y en el 3 % de los pacientes que recibieron N-AVD.
- En un análisis preliminar, publicado como resumen, se incluyeron 97 pacientes de 60 años. Al cabo de una mediana de seguimiento de 12,1 meses, la SSP a 1 año favoreció el régimen N-AVD, en comparación con el BV-AVD con una tasa del 93 % versus del 64 % (CRI, 0,35; IC 95 %, 0,12–1,02; P = 0,022).[
55 ] El grupo de BV-AVD presentó efectos secundarios mucho peores, como septicemia, neuropatía sensorial periférica, náusea, diarrea, anorexia y pérdida de peso, en comparación con el grupo de N-AVD que tuvo exantema e hipotiroidismo.[55 ] - A partir de las ventajas importantes sobre la SSP en los diferentes subgrupos de edad, estadio y puntuación de IPS, así como en la disminución de la toxicidad al evitar el uso de bleomicina o brentuximab vedotina, el régimen N-AVD se ha convertido en el tratamiento preferido para los pacientes con LH en estadio III y IV.
- Al cabo de una mediana de seguimiento de 2,1 años, la tasa de supervivencia sin progresión (SSP) a 2 años del 92 % (intervalo de confianza [IC] 95 %, 89–94 %) favoreció al régimen N-AVD sobre el régimen BV-AVD cuya tasa fue de 83 % (IC 95 %, 79–86 %) (cociente de riesgos instantáneos [CRI], 0,45; IC 95 %, 0,30–0,65; P = 0,001).[
- En un ensayo prospectivo aleatorizado (NCT01712490) se incluyeron 1334 pacientes con LH en estadio avanzado no tratado. En el estudio se comparó el régimen ABVD con el régimen BV-AVD.[
66 ]- Al cabo de una mediana de seguimiento de 73 meses, la tasa de SG a 6 años fue del 93,9 % (IC 95 %, 91,6–95,5 %) en los pacientes que recibieron BV-AVD y del 89,4 % (IC 95 %, 86,6–91,7 %) en los pacientes que recibieron ABVD (CRI, 0,59; IC 95 %, 0,40–0,88; P = 0,009).[
66 ][Nivel de evidencia A1] - Al cabo de una mediana de seguimiento de 73 meses, la tasa de SSP a 6 años fue del 82,3 % (IC 95 %, 79,1–85,0 %) en los pacientes que recibieron BV-AVD y del 74,5 % (IC 95 %, 70,8–77,7 %) en los pacientes que recibieron ABVD (CRI, 0,68; IC 95 %, 0,53–0,86; P = 0,002).[
66 ] - Entre los pacientes que recibieron BV-AVD, la neuropatía periférica de grados 3 o 4 fue significativamente más frecuente (67 vs. 43 %); sin embargo, se presentaron más de un 80 % de recuperaciones parciales o completas, y la mediana de tiempo de resolución fue de 16 semanas en el grupo de BV-AVD y de 10 semanas en el grupo de ABVD. Se produjeron 11 muertes por toxicidad pulmonar en el grupo ABVD.
- Si bien la fertilidad no se evaluó en forma directa, con posterioridad se presentaron embarazos y nacimientos en ambos grupos del ensayo, en pacientes mujeres y en parejas femeninas de pacientes hombres.
- El BV-AVD puede costar 50 veces más que el ABVD (en 2018).[
77 ] - El régimen BV-AVD es un nuevo tratamiento estándar para los pacientes con LH clásico en estadio avanzado.
- Al cabo de una mediana de seguimiento de 73 meses, la tasa de SG a 6 años fue del 93,9 % (IC 95 %, 91,6–95,5 %) en los pacientes que recibieron BV-AVD y del 89,4 % (IC 95 %, 86,6–91,7 %) en los pacientes que recibieron ABVD (CRI, 0,59; IC 95 %, 0,40–0,88; P = 0,009).[
- En múltiples ensayos prospectivos y en un metanálisis, se observó que la terapia ABVD administrada durante 6 a 8 meses a los pacientes con diagnóstico reciente de LH en estadio avanzado, produjo una supervivencia general (SG) equivalente cuando se comparó con otros regímenes (es decir, bleomicina, etopósido, doxorrubicina, ciclofosfamida, vincristina, procarbazina y prednisona [BEACOPP]; BEACOPP intensificado; doxorrubicina, vinblastina, mecloretamina, etopósido, vincristina, bleomicina y prednisona [Stanford V] y mecloretamina, vincristina, procarbazina y prednisona con doxorrubicina, bleomicina y vinblastina [MOPP-ABV]).[
88 ,99 ,1010 ,1111 ,1212 ,1313 ,1414 ,1515 ][Nivel de evidencia A1]
En múltiples estudios se abordó la función de la consolidación con radioterapia después de la inducción con quimioterapia para tratar el LH en estadio avanzado.
- En tres ensayos prospectivos aleatorizados no se observó beneficio para la SG con la adición de radioterapia de consolidación a la quimioterapia en pacientes con enfermedad en estadio avanzado.[
1616 ,1717 ,1818 ][Nivel de evidencia A1] - En un metanálisis de 1740 pacientes tratados en 14 ensayos diferentes, no se observó una mejora de la SG a 10 años en pacientes con LH en estadio avanzado sometidos a terapia de modalidad combinada versus quimioterapia sola.[
1919 ][Nivel de evidencia C1] - No se conoce ventaja alguna para la supervivencia del uso de la consolidación con radiación en pacientes con enfermedad mediastínica masiva y enfermedad en estadio avanzado.[
2020 ]En un ensayo prospectivo aleatorizado con una mediana de seguimiento de 5,9 años se incluyó a 320 pacientes con LH en estadio avanzado y una gran masa ganglionar (≥5 cm). Los pacientes se asignaron al azar para recibir radioterapia o ningún tratamiento posterior después de 6 ciclos de ABVD. En los pacientes con una respuesta metabólica completa en la tomografía por emisión de positrones (TEP)-tomografía computarizada (TC) después de 6 ciclos de ABVD, no hubo diferencia en la tasa de SSP a los 6 años entre los pacientes que recibieron radioterapia (91%; IC 95 %, 84–99 %) versus los pacientes que no recibieron tratamiento posterior (95%; IC 95 %, 89–100 %, P = 0,62).[
2121 ][Nivel de evidencia B1] - En el ensayo HD15 del German Hodgkin Lymphoma Study Group, se observó que un resultado negativo en la TEP luego de la terapia de inducción con BEACOPP (intensificada o administrada cada 14 días) para un LH en estadio avanzado fue muy predictivo de un desenlace favorable incluso con la omisión de la radioterapia de consolidación (valor predictivo de un resultado negativo de la TEP fue del 94 % [IC 95 %, 91–97 %]).[
2222 ] En el ensayo del German Hodgkin Study Group HD18 (NCT00515554), la TEP mostró negatividad después de 2 ciclos (TEP-2) de BEACOPP intensificado, lo que permitió la reducción a 4 ciclos de terapia, en lugar de 6 u 8, porque la SSP a 5 años fue equivalente (90,8 % vs. 92,2 %; diferencia del 1,4 %; IC 95 %, -2,7 a 5,4).[2323 ][Nivel de evidencia B1] En el estudio HD18 se estableció el puntaje de Deauville de 4 o 5 como un resultado positivo en la TEP2 a partir de la SG a 3 años.[2424 ]
En otros ensayos, se investigó la función de la TEP en pacientes de LH clásico en estadio avanzado.
- En un ensayo prospectivo aleatorizado con 1214 pacientes de LH en estadio avanzado ( RATHL [NCT00678327]) se investigó el uso de TEP-TC después de 2 ciclos de ABVD para modificar el tratamiento.[
2525 ,2626 ] Los pacientes con hallazgos negativos en la TEP-TC (puntaje de Deauville de 1, 2 o 3) se asignaron al azar para recibir 4 ciclos adicionales de ABVD versus 4 ciclos de AVD (doxorrubicina, vinblastina y dacarbazina).- Luego de una mediana de seguimiento de 7,3 años para los 937 pacientes con un resultado negativo en la TEP-TC, no hubo diferencia en la tasa de SG a 7 años (93,2 %; intervalo de confianza [IC] 95 %, 90,2–95,3 % para ABVD vs. 93,5 %; IC 95 %, 90,5–95,5 % para AVD).[
2626 ][Nivel de evidencia A1] - La diferencia absoluta en la tasa de SSP a 3 años (ABVD menos AVD) fue del 1,3 % (IC 95 %, -3,0 % a 4,7 %), lo que encaja dentro del margen predefinido de ausencia de inferioridad. Esto significó que no hubo una ventaja de SSP al continuar con la bleomicina para los pacientes con hallazgos negativos durante la TEP interina.
- Sin embargo, la toxicidad pulmonar fue peor en el grupo que continuó con ABVD, se presentaron muchos más episodios respiratorios de grado 3 o 4 y un empeoramiento a largo plazo de la capacidad de difusión pulmonar para el monóxido de carbono (DPCO) que persistió después de 1 año.
- En este estudio, se concluyó que es posible omitir la bleomicina después del segundo ciclo de ABVD si los hallazgos de la TEP-TC son negativos (puntaje de Deauville de 1, 2 o 3).
- Los pacientes con resultado positivo en la TEP-TC (puntaje de Deauville de 4 o 5) después de 2 ciclos de ABVD recibieron BEACOPP.
- Luego de una mediana de seguimiento de 41 meses, la tasa de SSP a 3 años para los 172 pacientes con resultado positivo en la TEP-TC, fue del 67,5 % y la tasa de SG fue del 87,8 %.
- En este ensayo, no se estableció que el cambio a BEACOPP fuera superior a seguir con ABVD.
- Luego de una mediana de seguimiento de 7,3 años para los 937 pacientes con un resultado negativo en la TEP-TC, no hubo diferencia en la tasa de SG a 7 años (93,2 %; intervalo de confianza [IC] 95 %, 90,2–95,3 % para ABVD vs. 93,5 %; IC 95 %, 90,5–95,5 % para AVD).[
- En un ensayo no aleatorizado (SWOG S0816 [NCT00822120]), 336 pacientes con LH avanzado recibieron 2 ciclos de ABVD y luego se evaluaron mediante TEP.[
2727 ] Los pacientes con resultado negativo en la TEP-2 (puntaje de Deauville de 1 a 3) completaron 4 ciclos adicionales de ABVD, mientras que los pacientes con un resultado positivo en la TEP-2 (18 % del total) cambiaron al grupo que recibió BEACOPP intensificado.- Después de una mediana de seguimiento de 5,9 años, la tasa de SSP a 5 años para los pacientes con resultado positivo en la TEP-2 fue del 66 % (IC 95 %, 52–76 %).[
2727 ][Nivel de evidencia C3]
- Después de una mediana de seguimiento de 5,9 años, la tasa de SSP a 5 años para los pacientes con resultado positivo en la TEP-2 fue del 66 % (IC 95 %, 52–76 %).[
También se estudió a pacientes de más edad con linfoma de Hodgkin en estadio avanzado.
- En un estudio multicéntrico de fase II, 48 pacientes mayores de 60 años, de los que el 81 % tenían enfermedad en estadio avanzado, recibieron 2 dosis consecutivas de brentuximab vedotina, seguidas de 6 ciclos de AVD, seguida de 4 dosis adicionales de brentuximab vedotina.[
2828 ]- La tasa de supervivencia sin complicaciones a 2 años fue del 80 %, la tasa de SSP fue del 84 % y la tasa de SG fue del 93 %.[
2828 ][Nivel de evidencia C3] - De los pacientes, el 42 % experimentaron efectos tóxicos de grados 3 o 4.
- La tasa de supervivencia sin complicaciones a 2 años fue del 80 %, la tasa de SSP fue del 84 % y la tasa de SG fue del 93 %.[
Resumen de linfoma de Hodgkin clásico en estadio avanzado:
- En pacientes con LH en estadio avanzado, ahora el abordaje estándar es el uso de 6 ciclos de N-AVD. En los casos de posible contraindicación de la inmunoterapia (por ejemplo, por vasculitis o colitis inflamatoria activa), el régimen BV-AVD es una buena opción.
- Cuando la toxicidad financiera de N-AVD o BV-AVD imposibilita su uso (por ejemplo, en una nación con limitadas opciones de atención sanitaria), el régimen ABVD continúa siendo un abordaje razonable y rentable. Para pacientes que muestran negatividad en la TEP-TC después del segundo ciclo de ABVD, es posible omitir la bleomicina del régimen de quimioterapia con poca pérdida de eficacia y mejor tolerabilidad.
Ensayos clínicos en curso
Realizar una
Referencias:
- Moccia AA, Donaldson J, Chhanabhai M, et al.: International Prognostic Score in advanced-stage Hodgkin's lymphoma: altered utility in the modern era. J Clin Oncol 30 (27): 3383-8, 2012.
- Connors JM, Jurczak W, Straus DJ, et al.: Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin's Lymphoma. N Engl J Med 378 (4): 331-344, 2018.
- Straus DJ, Długosz-Danecka M, Alekseev S, et al.: Brentuximab vedotin with chemotherapy for stage III/IV classical Hodgkin lymphoma: 3-year update of the ECHELON-1 study. Blood 135 (10): 735-742, 2020.
- Herrera AF, LeBlanc M, Castellino SM, et al.: Nivolumab+AVD in Advanced-Stage Classic Hodgkin's Lymphoma. N Engl J Med 391 (15): 1379-1389, 2024.
- Rutherford SC, Li H, Herrera AF, et al.: Nivolumab-AVD is better tolerated and improves progression-free survival compared to Bv-AVD in older patients (aged ≥60 years) with advanced stage Hodgkin lymphoma enrolled on SWOG S1826. [Abstract] Blood 142 (Suppl 1): A-624, 181, 2023.
- Ansell SM, Radford J, Connors JM, et al.: Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin's Lymphoma. N Engl J Med 387 (4): 310-320, 2022.
- Huntington SF, von Keudell G, Davidoff AJ, et al.: Cost-Effectiveness Analysis of Brentuximab Vedotin With Chemotherapy in Newly Diagnosed Stage III and IV Hodgkin Lymphoma. J Clin Oncol : JCO1800122, 2018.
- Canellos GP, Niedzwiecki D: Long-term follow-up of Hodgkin's disease trial. N Engl J Med 346 (18): 1417-8, 2002.
- Duggan DB, Petroni GR, Johnson JL, et al.: Randomized comparison of ABVD and MOPP/ABV hybrid for the treatment of advanced Hodgkin's disease: report of an intergroup trial. J Clin Oncol 21 (4): 607-14, 2003.
- Federico M, Luminari S, Iannitto E, et al.: ABVD compared with BEACOPP compared with CEC for the initial treatment of patients with advanced Hodgkin's lymphoma: results from the HD2000 Gruppo Italiano per lo Studio dei Linfomi Trial. J Clin Oncol 27 (5): 805-11, 2009.
- Viviani S, Zinzani PL, Rambaldi A, et al.: ABVD versus BEACOPP for Hodgkin's lymphoma when high-dose salvage is planned. N Engl J Med 365 (3): 203-12, 2011.
- Bauer K, Skoetz N, Monsef I, et al.: Comparison of chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for patients with early unfavourable or advanced stage Hodgkin lymphoma. Cochrane Database Syst Rev (8): CD007941, 2011.
- Chisesi T, Bellei M, Luminari S, et al.: Long-term follow-up analysis of HD9601 trial comparing ABVD versus Stanford V versus MOPP/EBV/CAD in patients with newly diagnosed advanced-stage Hodgkin's lymphoma: a study from the Intergruppo Italiano Linfomi. J Clin Oncol 29 (32): 4227-33, 2011.
- Carde P, Karrasch M, Fortpied C, et al.: Eight Cycles of ABVD Versus Four Cycles of BEACOPPescalated Plus Four Cycles of BEACOPPbaseline in Stage III to IV, International Prognostic Score ≥ 3, High-Risk Hodgkin Lymphoma: First Results of the Phase III EORTC 20012 Intergroup Trial. J Clin Oncol 34 (17): 2028-36, 2016.
- Mounier N, Brice P, Bologna S, et al.: ABVD (8 cycles) versus BEACOPP (4 escalated cycles ≥ 4 baseline): final results in stage III-IV low-risk Hodgkin lymphoma (IPS 0-2) of the LYSA H34 randomized trial. Ann Oncol 25 (8): 1622-8, 2014.
- Fabian CJ, Mansfield CM, Dahlberg S, et al.: Low-dose involved field radiation after chemotherapy in advanced Hodgkin disease. A Southwest Oncology Group randomized study. Ann Intern Med 120 (11): 903-12, 1994.
- Aleman BM, Raemaekers JM, Tirelli U, et al.: Involved-field radiotherapy for advanced Hodgkin's lymphoma. N Engl J Med 348 (24): 2396-406, 2003.
- Fermé C, Mounier N, Casasnovas O, et al.: Long-term results and competing risk analysis of the H89 trial in patients with advanced-stage Hodgkin lymphoma: a study by the Groupe d'Etude des Lymphomes de l'Adulte (GELA). Blood 107 (12): 4636-42, 2006.
- Loeffler M, Brosteanu O, Hasenclever D, et al.: Meta-analysis of chemotherapy versus combined modality treatment trials in Hodgkin's disease. International Database on Hodgkin's Disease Overview Study Group. J Clin Oncol 16 (3): 818-29, 1998.
- Brice P, Colin P, Berger F, et al.: Advanced Hodgkin disease with large mediastinal involvement can be treated with eight cycles of chemotherapy alone after a major response to six cycles of chemotherapy: a study of 82 patients from the Groupes d'Etudes des Lymphomes de l'Adulte H89 trial. Cancer 92 (3): 453-9, 2001.
- Gallamini A, Rossi A, Patti C, et al.: Consolidation Radiotherapy Could Be Safely Omitted in Advanced Hodgkin Lymphoma With Large Nodal Mass in Complete Metabolic Response After ABVD: Final Analysis of the Randomized GITIL/FIL HD0607 Trial. J Clin Oncol 38 (33): 3905-3913, 2020.
- Kobe C, Dietlein M, Franklin J, et al.: Positron emission tomography has a high negative predictive value for progression or early relapse for patients with residual disease after first-line chemotherapy in advanced-stage Hodgkin lymphoma. Blood 112 (10): 3989-94, 2008.
- Borchmann P, Goergen H, Kobe C, et al.: PET-guided treatment in patients with advanced-stage Hodgkin's lymphoma (HD18): final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet 390 (10114): 2790-2802, 2018.
- Kobe C, Goergen H, Baues C, et al.: Outcome-based interpretation of early interim PET in advanced-stage Hodgkin lymphoma. Blood 132 (21): 2273-2279, 2018.
- Johnson P, Federico M, Kirkwood A, et al.: Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin's Lymphoma. N Engl J Med 374 (25): 2419-29, 2016.
- Luminari S, Fossa A, Trotman J, et al.: Long-Term Follow-Up of the Response-Adjusted Therapy for Advanced Hodgkin Lymphoma Trial. J Clin Oncol 42 (1): 13-18, 2024.
- Stephens DM, Li H, Schöder H, et al.: Five-year follow-up of SWOG S0816: limitations and values of a PET-adapted approach with stage III/IV Hodgkin lymphoma. Blood 134 (15): 1238-1246, 2019.
- Evens AM, Advani RH, Helenowski IB, et al.: Multicenter Phase II Study of Sequential Brentuximab Vedotin and Doxorubicin, Vinblastine, and Dacarbazine Chemotherapy for Older Patients With Untreated Classical Hodgkin Lymphoma. J Clin Oncol 36 (30): 3015-3022, 2018.
Tratamiento del linfoma de Hodgkin clásico recidivante
Más de la mitad de los pacientes de linfoma de Hodgkin (LH) recidivante pueden lograr una supervivencia sin enfermedad (SSE) a largo plazo, o incluso la cura, mediante la administración de terapia de reinducción seguida de consolidación con trasplante de células madre o de médula ósea.[
- Enfermedad primaria resistente al tratamiento (pronóstico más precario).
- Recaída menos de 12 meses después del tratamiento inicial. Entre los pacientes que en un comienzo presentan enfermedad temprana favorable que recae, más del 75 % presentan una recaída pasados 12 meses del diagnóstico.[
55 ] - Imposibilidad de lograr una remisión clínica completa después de la reinducción (por ejemplo, los resultados de la tomografía por emisión de positrones con tomografía computarizada [TEP-TC] son positivos con un puntaje de Deauville de 4 o 5 y más tarde se observa progresión en tamaño o sitios de enfermedad).
-
Síntomas BSíntomas B en el momento de la recaída. - Enfermedad extraganglionar en el momento de la recaída.
- Administración de más de dos regímenes de rescate previos.
Opciones de tratamiento del linfoma de Hodgkin clásico recidivante
Las opciones de tratamiento del linfoma de Hodgkin clásico recidivante son las siguientes:
-
Pembrolizumab o nivolumab (solo o con quimioterapia)Pembrolizumab o nivolumab (solo o con quimioterapia) . -
Brentuximab vedotinaBrentuximab vedotina . -
Brentuximab vedotina y nivolumabBrentuximab vedotina y nivolumab . -
Quimioterapia con trasplante de células madreQuimioterapia con trasplante de células madre . -
Quimioterapia combinadaQuimioterapia combinada . -
RadioterapiaRadioterapia .
Pembrolizumab o nivolumab (solo o con quimioterapia)
Los anticuerpos monoclonales contra la proteína de muerte celular programada-1 (PD-1) pembrolizumab y nivolumab son inhibidores de puntos de control inmunitario.
Evidencia (pembrolizumab):
- En un ensayo de fase II participaron 37 pacientes con enfermedad en recaída o resistente al tratamiento que recibieron 3 ciclos de pembrolizumab con 2 ciclos de quimioterapia con ifosfamida, carboplatino y etopósido (ICE) cada 21 días antes de un TCM autógeno.[
66 ][Nivel de evidencia C3]- La tasa de respuesta completa fue del 86,5 % (intervalo de confianza [IC] 95 %, 71,2–95,5 %), y la tasa de respuesta general fue del 97,3 %. No hubo deterioro en la movilización de las células madre.
- En un ensayo de fase II se incluyeron 39 pacientes con enfermedad en recaída o resistente al tratamiento aptos para trasplante. Los pacientes recibieron pembrolizumab con quimioterapia de gemcitabina, vinorelbina y doxorrubicina liposomal (GVD).[
77 ]- Al cabo de una mediana de seguimiento de 13,5 meses, la tasa de respuesta general fue del 100 % y la tasa de respuesta completa fue del 95 %.[
77 ][Nivel de evidencia C3] - De los pacientes, 36 (35 %) recibieron un TCM autógeno de consolidación.
- Al cabo de una mediana de seguimiento de 13,5 meses, la tasa de respuesta general fue del 100 % y la tasa de respuesta completa fue del 95 %.[
- En un ensayo aleatorizado prospectivo se incluyeron 304 pacientes con enfermedad resistente al tratamiento o en recaída que no eran aptos para recibir un trasplante autógeno de células madre o tuvieron una recaída después del trasplante. Los pacientes se asignaron a recibir pembrolizumab o brentuximab vedotina.[
88 ]- Al cabo de una mediana de seguimiento de 25,7 meses, la mediana de supervivencia sin progresión (SSP) en los pacientes que recibieron pembrolizumab fue de 13,2 meses (IC 95 %, 10,9–19,4) versus 8,3 meses (IC 95 %, 5,7–8,8) en los pacientes que recibieron brentuximab vedotina (cociente de riesgos instantáneos [CRI], 0,65; IC 95 %, 0,48–0,88; P = 0,0027).[
88 ][Nivel de evidencia B1] - Se produjeron eventos adversos graves relacionados con el tratamiento en un 16 % de los pacientes que recibieron pembrolizumab y en un 11 % de los pacientes que recibieron brentuximab vedotina.
- Al cabo de una mediana de seguimiento de 25,7 meses, la mediana de supervivencia sin progresión (SSP) en los pacientes que recibieron pembrolizumab fue de 13,2 meses (IC 95 %, 10,9–19,4) versus 8,3 meses (IC 95 %, 5,7–8,8) en los pacientes que recibieron brentuximab vedotina (cociente de riesgos instantáneos [CRI], 0,65; IC 95 %, 0,48–0,88; P = 0,0027).[
- En los estudios con pacientes de LH en recaída tratados con pembrolizumab, se notificó lo siguiente:[
99 ,1010 ][Nivel de evidencia C3]- La tasa de respuesta general fue del 64 % al 74 %; la tasa de respuesta completa fue del 22,4 % (IC 95 %, 6,9–28,6 %).
- Los pacientes toleraron bien el pembrolizumab y se puede utilizar para lograr una remisión clínica completa antes de un trasplante autógeno o alogénico de células madre.
- La Administración de Alimentos y Medicamentos(FDA) de los Estados Unidos aprobó el uso de pembrolizumab en casos de enfermedad resistente al tratamiento o en recaída después de 3 o más líneas de tratamiento.
Evidencia (nivolumab solo o nivolumab con ICE):
- En los estudios de pacientes con LH en recaída tratados con nivolumab, se notificó lo siguiente:[
1111 ,1212 ,1313 ][Nivel de evidencia C3]- La tasa de respuesta general fue del 65 % al 87 % y la tasa de respuesta completa fue del 16 % al 28 %; la duración de las respuestas por lo general fue de más de 1 año en los pacientes con enfermedad en recaída que habían recibido antes varios tratamientos.
- Los pacientes toleraron bien el nivolumab y se puede utilizar para lograr una remisión clínica completa antes de un trasplante autógeno o alogénico de células madre.
- La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el uso del nivolumab en pacientes con recaída posterior a un trasplante de células madre y en pacientes que recibieron antes brentuximab vedotina. También se aprobó el uso de nivolumab en pacientes que en el pasado recibieron 3 tratamientos distintos, incluso un trasplante de células madre.
- En un ensayo de fase II se administró a los pacientes nivolumab por 3 meses. Los que alcanzaron una respuesta completa recibieron un TCM autógeno, mientras que aquellos con respuesta parcial o menor de la enfermedad recibieron el régimen de nivolumab, ifosfamida, carboplatino y etopósido (NICE).[
1414 ]- La inducción con nivolumab se administró a 34 pacientes; 9 de ellos necesitaron recibir NICE porque la tasa de respuesta completa fue del 71 % para el nivolumab. Después de todo el tratamiento, la tasa de respuesta general fue del 93 % y la tasa de respuesta completa fue del 91 %. Las tasas a 2 años fueron para la SSP del 72 %, y para la SG del 95 %.[
1414 ][Nivel de evidencia C3]
- La inducción con nivolumab se administró a 34 pacientes; 9 de ellos necesitaron recibir NICE porque la tasa de respuesta completa fue del 71 % para el nivolumab. Después de todo el tratamiento, la tasa de respuesta general fue del 93 % y la tasa de respuesta completa fue del 91 %. Las tasas a 2 años fueron para la SSP del 72 %, y para la SG del 95 %.[
Brentuximab vedotina
El brentuximab vedotina es un conjugado anticuerpo-fármaco anti CD30.[
Evidencia (brentuximab vedotina):
- En múltiples ensayos clínicos de pacientes con enfermedad en recaída, incluso un ensayo después de un trasplante alogénico de células madre, se observaron los siguientes resultados:
- En pacientes con enfermedad en recaída, las tasas de respuesta fueron de cerca del 75 %. Las tasas de remisión completa fueron cercanas al 50 % y la mediana de SSP fue de 4 a 8 meses.[
1515 ,1616 ,1717 ,1818 ,1919 ][Nivel de evidencia C3]
- En pacientes con enfermedad en recaída, las tasas de respuesta fueron de cerca del 75 %. Las tasas de remisión completa fueron cercanas al 50 % y la mediana de SSP fue de 4 a 8 meses.[
- Se administró brentuximab vedotina a 27 pacientes mayores de 60 años sin tratamiento previo y que, según el criterio del investigador, tenían un estado de salud precario y no se podían someter a quimioterapia.[
2020 ]- Se notificó una tasa de respuesta general del 92 % y una tasa de remisión completa del 73 %.[
2020 ][Nivel de evidencia C3]
- Se notificó una tasa de respuesta general del 92 % y una tasa de remisión completa del 73 %.[
- En los pacientes con enfermedad en recaída, la repetición del tratamiento con brentuximab vedotina fue exitosa; la tasa de respuesta fue del 60 %.[
2121 ][Nivel de evidencia C3] - En el ensayo con enmascaramiento doble AETHERA (NCT01100502), se evaluó brentuximab vedotina versus un placebo en 329 pacientes con riesgo alto de LH residual después de un trasplante de células madre.[
2222 ,2323 ]- Después de una mediana de seguimiento de 5 años, la tasa de SSP a 5 años para brentuximab vedotina fue del 59 % (IC 95 %, 51–66 %) versus el 41 % (IC 95 %, 33–49 %) para un placebo (CRI, 0,521; IC 95 %, 0,379–0,717).[
2222 ,2323 ][Nivel de evidencia B1] - La mayoría de los pacientes no cumplieron con el período de 16 meses de tratamiento porque presentaron neuropatía periférica progresiva, que se revirtió de manera parcial después de la interrupción del brentuximab vedotina.
- Después de una mediana de seguimiento de 5 años, la tasa de SSP a 5 años para brentuximab vedotina fue del 59 % (IC 95 %, 51–66 %) versus el 41 % (IC 95 %, 33–49 %) para un placebo (CRI, 0,521; IC 95 %, 0,379–0,717).[
- En dos estudios de fase I/II, 120 pacientes con LH en recaída o resistente al tratamiento recibieron brentuximab vedotina y bendamustina.[
2424 ]- Después de 2 ciclos, las tasas de respuesta objetiva fueron del 93 % y del 78 %, y las tasas de remisión completa fueron del 74 % y del 32 %.[
2424 ,2525 ][Nivel de evidencia C3]
- Después de 2 ciclos, las tasas de respuesta objetiva fueron del 93 % y del 78 %, y las tasas de remisión completa fueron del 74 % y del 32 %.[
Brentuximab vedotina y nivolumab
Evidencia (brentuximab vedotina y nivolumab):
- En un ensayo de fase II, 91 pacientes con LH en recaída o resistente al tratamiento recibieron brentuximab vedotina y nivolumab.[
2626 ] Se autorizó la participación en el estudio a pacientes que habían recibido tratamiento anterior con brentuximab vedotina, siempre que el paciente no presentara resistencia o intolerancia al medicamento.- Al cabo de una mediana de seguimiento de 34,3 meses, la tasa de respuesta general fue del 85 % y la tasa de respuesta completa fue del 67 %. La tasa de SSP a 3 años fue del 77 % (IC 95 %, 65–86 %) en todos los pacientes y del 91 % (IC 95 %, 79–96%) en aquellos que recibieron trasplante autógeno de células madre. La tasa de SG a 3 años fue del 93% (IC 95 %, 85–97 %).[
2626 ][Nivel de evidencia C3] - En este ensayo, el 16 % de los pacientes presentaron eventos adversos que requirieron tratamiento con corticoesteroides.
- Al cabo de una mediana de seguimiento de 34,3 meses, la tasa de respuesta general fue del 85 % y la tasa de respuesta completa fue del 67 %. La tasa de SSP a 3 años fue del 77 % (IC 95 %, 65–86 %) en todos los pacientes y del 91 % (IC 95 %, 79–96%) en aquellos que recibieron trasplante autógeno de células madre. La tasa de SG a 3 años fue del 93% (IC 95 %, 85–97 %).[
- En un estudio de fase I/II, con 59 pacientes de LH en recaída o resistentes al tratamiento, se toleró bien el uso de la combinación de nivolumab y brentuximab vedotina (<10 % de los pacientes necesitaron corticoesteroides sistémicos).[
2727 ][Nivel de evidencia C3]- Al cabo de una mediana de seguimiento de 28,9 meses, la tasa de SSP a 18 meses fue del 94 % (IC 95 %, 84–98 %).
- Los eventos adversos incluyeron neuropatía periférica (53 %), neutropenia (42 %) y efectos adversos inmunitarios que necesitaron de corticoesteroides (29 %).[
2727 ]
Quimioterapia con trasplante de células madre
Los pacientes cuyo LH presenta una recaída después de recibir quimioterapia combinada inicial se pueden someter a una reinducción con el mismo régimen o con un nuevo régimen quimioterapéutico seguido de dosis altas de quimioterapia y rescate autógeno de médula ósea o células madre periféricas, o rescate alogénico de médula ósea.[
Los pacientes que no responden bien a la quimioterapia de inducción (20 a 25 % de todos los pacientes) tienen tasas de supervivencia a 8 años inferiores al 10 %.[
En una revisión retrospectiva de 105 pacientes, a los mayores de 60 años les fue mejor cuando recibieron una combinación de quimioterapia y radioterapia de rescate en comparación con una consolidación intensificada con trasplante.[
El uso de médula de un hermano con compatibilidad de HLA (trasplante alogénico) produce tasas de recaída más bajas, pero es posible que este beneficio se neutralice por el aumento de efectos tóxicos.[
Evidencia (quimioterapia con trasplante de células madre):
- En un ensayo aleatorizado, se comparó la quimioterapia convencional intensiva versus las dosis altas de quimioterapia con trasplante autógeno de células madre para los casos de LH con recaída quimiosensible.[
4444 ][Nivel de evidencia B1]- En este ensayo, se observó una mejora en el período sin fracaso terapéutico a los 3 años para el grupo de trasplante (55 %) versus el grupo de quimioterapia sola (34 %).[
4444 ] - No se observó diferencia en la supervivencia general (SG).
- En este ensayo, se observó una mejora en el período sin fracaso terapéutico a los 3 años para el grupo de trasplante (55 %) versus el grupo de quimioterapia sola (34 %).[
- En un metanálisis del Cochrane, también se concluyó que el trasplante autógeno de células madre después de la reinducción con quimioterapia mejora la supervivencia sin recaída en el 20 al 30 % en comparación con la quimioterapia sola, pero sin beneficio para la SG.[
4545 ][Nivel de evidencia B1] - En 3 revisiones retrospectivas de pacientes sometidos a trasplante autógeno de médula ósea para una recaída o enfermedad resistente al tratamiento, se comparó a los pacientes que recibieron radioterapia dirigida al campo comprometido (RTCC) por masas residuales después de recibir terapia de dosis altas y los pacientes que no recibieron tratamiento adicional.[
4646 ,4747 ,4848 ]- En los pacientes que recibieron RTCC se redujo la recidiva local de la enfermedad.
- En un ensayo de fase II, la normalización del resultado de la TEP con flúor F 18-fludesoxiglucosa combinada con TC después de la terapia de reinducción predijo un desenlace mucho más favorable después del trasplante de células madre, con una tasa de SSC del 80 % vs. 29 %.[
3232 ][Nivel de evidencia C2]
En el ensayo con enmascaramiento doble AETHERA [NCT01100502], 329 pacientes se asignaron al azar para recibir brentuximab vedotina o un placebo después de un trasplante autógeno de células madre por un LH recidivante.[
- Con una mediana de seguimiento de 5,0 años, la tasa de SSP a 5 años para brentuximab vedotina fue del 59 % (IC 95 %, 51–66 %) versus 41 % (IC 95 %, 33–49 %) para un placebo (CRI, 0,521; IC 95 %, 0,379–0,717).[
2222 ,2323 ][Nivel de evidencia B1] - La mayoría de los pacientes no cumplieron con el período de 16 meses de tratamiento porque presentaron neuropatía periférica progresiva, que se revirtió de manera parcial después de la interrupción del brentuximab vedotina.
- No queda claro si los resultados de este ensayo se pueden aplicar cuando se administra brentuximab vedotina antes del trasplante; por ejemplo, durante la reinducción después de la recaída o durante el tratamiento inicial (en evaluación en este momento).
En un ensayo de fase II, se notificó una tasa de respuesta superior al 50 % en pacientes con enfermedad recidivante después de un trasplante autógeno de médula ósea.[
Quimioterapia combinada
En los pacientes que sufren una recaída después de la quimioterapia combinada inicial, el pronóstico se determina más a partir de la duración de la primera remisión que a partir del tipo de inducción o el régimen de quimioterapia combinada de rescate. Los pacientes cuya remisión inicial después de la quimioterapia dura más de 1 año (recaída tardía) logran una supervivencia a largo plazo del 22 % al 71 % con la quimioterapia de rescate.[
Es poco frecuente ver a un paciente que solo recibió radioterapia como tratamiento inicial, pero los pacientes que recaen después de dosis altas de radioterapia de campo ampliado tienen un pronóstico favorable. La quimioterapia combinada produce tasas de SSE a 10 años del 57 % al 81 % y tasas de SG del 57 % al 89 %.[
Radioterapia
En el pequeño subgrupo de pacientes que solo tienen recidiva ganglionar limitada después de la quimioterapia inicial, es posible que la radioterapia, con quimioterapia adicional o sin esta, produzca supervivencia a largo plazo de cerca del 50 % en estos pacientes muy seleccionados.[
Resumen de terapias en secuencia para el linfoma de Hodgkin clásico recidivante
- Se debe considerar la administración de la combinación de nivolumab y brentuximab vedotina para los pacientes con enfermedad recidivante que no recibieron brentuximab vedotina ni un inhibidor de puntos de control.[
2626 ,6060 ] - La combinación de pembrolizumab con quimioterapia ICE,[
66 ] nivolumab con quimioterapia ICE[1414 ] o pembrolizumab con quimioterapia GVD [77 ] son terapias de inducción eficaces previas a un TCM autógeno. - Se considera el uso de un trasplante alogénico de células madre en los pacientes con enfermedad primaria resistente al tratamiento que obtuvieron una respuesta parcial o una remisión completa con la terapia de rescate.
- Los inhibidores de puntos de control solos sirven como sustancias paliativas para los pacientes de más edad o aquellos con comorbilidades que impiden un TCM.
Ensayos clínicos en curso
Realizar una
Referencias:
- Holmberg L, Maloney DG: The role of autologous and allogeneic hematopoietic stem cell transplantation for Hodgkin lymphoma. J Natl Compr Canc Netw 9 (9): 1060-71, 2011.
- Josting A, Franklin J, May M, et al.: New prognostic score based on treatment outcome of patients with relapsed Hodgkin's lymphoma registered in the database of the German Hodgkin's lymphoma study group. J Clin Oncol 20 (1): 221-30, 2002.
- Bonfante V, Santoro A, Viviani S, et al.: Outcome of patients with Hodgkin's disease failing after primary MOPP-ABVD. J Clin Oncol 15 (2): 528-34, 1997.
- Garcia-Carbonero R, Paz-Ares L, Arcediano A, et al.: Favorable prognosis after late relapse of Hodgkin's disease. Cancer 83 (3): 560-5, 1998.
- Bröckelmann PJ, Müller H, Guhl T, et al.: Relapse After Early-Stage, Favorable Hodgkin Lymphoma: Disease Characteristics and Outcomes With Conventional or High-Dose Chemotherapy. J Clin Oncol 39 (2): 107-115, 2021.
- Bryan LJ, Casulo C, Allen PB, et al.: Pembrolizumab Added to Ifosfamide, Carboplatin, and Etoposide Chemotherapy for Relapsed or Refractory Classic Hodgkin Lymphoma: A Multi-institutional Phase 2 Investigator-Initiated Nonrandomized Clinical Trial. JAMA Oncol 9 (5): 683-691, 2023.
- Moskowitz AJ, Shah G, Schöder H, et al.: Phase II Trial of Pembrolizumab Plus Gemcitabine, Vinorelbine, and Liposomal Doxorubicin as Second-Line Therapy for Relapsed or Refractory Classical Hodgkin Lymphoma. J Clin Oncol 39 (28): 3109-3117, 2021.
- Kuruvilla J, Ramchandren R, Santoro A, et al.: Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma (KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol 22 (4): 512-524, 2021.
- Armand P, Shipp MA, Ribrag V, et al.: Programmed Death-1 Blockade With Pembrolizumab in Patients With Classical Hodgkin Lymphoma After Brentuximab Vedotin Failure. J Clin Oncol 34 (31): 3733-3739, 2016.
- Chen R, Zinzani PL, Lee HJ, et al.: Pembrolizumab in relapsed or refractory Hodgkin lymphoma: 2-year follow-up of KEYNOTE-087. Blood 134 (14): 1144-1153, 2019.
- Ansell SM, Lesokhin AM, Borrello I, et al.: PD-1 blockade with nivolumab in relapsed or refractory Hodgkin's lymphoma. N Engl J Med 372 (4): 311-9, 2015.
- Younes A, Santoro A, Shipp M, et al.: Nivolumab for classical Hodgkin's lymphoma after failure of both autologous stem-cell transplantation and brentuximab vedotin: a multicentre, multicohort, single-arm phase 2 trial. Lancet Oncol 17 (9): 1283-94, 2016.
- Armand P, Engert A, Younes A, et al.: Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II CheckMate 205 Trial. J Clin Oncol 36 (14): 1428-1439, 2018.
- Mei MG, Lee HJ, Palmer JM, et al.: Response-adapted anti-PD-1-based salvage therapy for Hodgkin lymphoma with nivolumab alone or in combination with ICE. Blood 139 (25): 3605-3616, 2022.
- Gopal AK, Ramchandren R, O'Connor OA, et al.: Safety and efficacy of brentuximab vedotin for Hodgkin lymphoma recurring after allogeneic stem cell transplantation. Blood 120 (3): 560-8, 2012.
- Younes A, Bartlett NL, Leonard JP, et al.: Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med 363 (19): 1812-21, 2010.
- Younes A, Gopal AK, Smith SE, et al.: Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma. J Clin Oncol 30 (18): 2183-9, 2012.
- Chen R, Palmer JM, Thomas SH, et al.: Brentuximab vedotin enables successful reduced-intensity allogeneic hematopoietic cell transplantation in patients with relapsed or refractory Hodgkin lymphoma. Blood 119 (26): 6379-81, 2012.
- Bazarbachi A, Boumendil A, Finel H, et al.: Brentuximab vedotin for recurrent Hodgkin lymphoma after allogeneic hematopoietic stem cell transplantation: A report from the EBMT Lymphoma Working Party. Cancer 125 (1): 90-98, 2019.
- Forero-Torres A, Holkova B, Goldschmidt J, et al.: Phase 2 study of frontline brentuximab vedotin monotherapy in Hodgkin lymphoma patients aged 60 years and older. Blood 126 (26): 2798-804, 2015.
- Bartlett NL, Chen R, Fanale MA, et al.: Retreatment with brentuximab vedotin in patients with CD30-positive hematologic malignancies. J Hematol Oncol 7: 24, 2014.
- Moskowitz CH, Nademanee A, Masszi T, et al.: Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin's lymphoma at risk of relapse or progression (AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 385 (9980): 1853-62, 2015.
- Moskowitz CH, Walewski J, Nademanee A, et al.: Five-year PFS from the AETHERA trial of brentuximab vedotin for Hodgkin lymphoma at high risk of progression or relapse. Blood 132 (25): 2639-2642, 2018.
- LaCasce AS, Bociek RG, Sawas A, et al.: Brentuximab vedotin plus bendamustine: a highly active first salvage regimen for relapsed or refractory Hodgkin lymphoma. Blood 132 (1): 40-48, 2018.
- O'Connor OA, Lue JK, Sawas A, et al.: Brentuximab vedotin plus bendamustine in relapsed or refractory Hodgkin's lymphoma: an international, multicentre, single-arm, phase 1-2 trial. Lancet Oncol 19 (2): 257-266, 2018.
- Advani RH, Moskowitz AJ, Bartlett NL, et al.: Brentuximab vedotin in combination with nivolumab in relapsed or refractory Hodgkin lymphoma: 3-year study results. Blood 138 (6): 427-438, 2021.
- Herrera AF, Chen L, Nieto Y, et al.: Brentuximab vedotin plus nivolumab after autologous haematopoietic stem-cell transplantation for adult patients with high-risk classic Hodgkin lymphoma: a multicentre, phase 2 trial. Lancet Haematol 10 (1): e14-e23, 2023.
- Akpek G, Ambinder RF, Piantadosi S, et al.: Long-term results of blood and marrow transplantation for Hodgkin's lymphoma. J Clin Oncol 19 (23): 4314-21, 2001.
- Tarella C, Cuttica A, Vitolo U, et al.: High-dose sequential chemotherapy and peripheral blood progenitor cell autografting in patients with refractory and/or recurrent Hodgkin lymphoma: a multicenter study of the intergruppo Italiano Linfomi showing prolonged disease free survival in patients treated at first recurrence. Cancer 97 (11): 2748-59, 2003.
- Shah GL, Moskowitz CH: Transplant strategies in relapsed/refractory Hodgkin lymphoma. Blood 131 (15): 1689-1697, 2018.
- Martínez C, Gayoso J, Canals C, et al.: Post-Transplantation Cyclophosphamide-Based Haploidentical Transplantation as Alternative to Matched Sibling or Unrelated Donor Transplantation for Hodgkin Lymphoma: A Registry Study of the Lymphoma Working Party of the European Society for Blood and Marrow Transplantation. J Clin Oncol 35 (30): 3425-3432, 2017.
- Moskowitz CH, Matasar MJ, Zelenetz AD, et al.: Normalization of pre-ASCT, FDG-PET imaging with second-line, non-cross-resistant, chemotherapy programs improves event-free survival in patients with Hodgkin lymphoma. Blood 119 (7): 1665-70, 2012.
- Fermé C, Mounier N, Diviné M, et al.: Intensive salvage therapy with high-dose chemotherapy for patients with advanced Hodgkin's disease in relapse or failure after initial chemotherapy: results of the Groupe d'Etudes des Lymphomes de l'Adulte H89 Trial. J Clin Oncol 20 (2): 467-75, 2002.
- Gopal AK, Metcalfe TL, Gooley TA, et al.: High-dose therapy and autologous stem cell transplantation for chemoresistant Hodgkin lymphoma: the Seattle experience. Cancer 113 (6): 1344-50, 2008.
- Morschhauser F, Brice P, Fermé C, et al.: Risk-adapted salvage treatment with single or tandem autologous stem-cell transplantation for first relapse/refractory Hodgkin's lymphoma: results of the prospective multicenter H96 trial by the GELA/SFGM study group. J Clin Oncol 26 (36): 5980-7, 2008.
- Nademanee A, O'Donnell MR, Snyder DS, et al.: High-dose chemotherapy with or without total body irradiation followed by autologous bone marrow and/or peripheral blood stem cell transplantation for patients with relapsed and refractory Hodgkin's disease: results in 85 patients with analysis of prognostic factors. Blood 85 (5): 1381-90, 1995.
- Horning SJ, Chao NJ, Negrin RS, et al.: High-dose therapy and autologous hematopoietic progenitor cell transplantation for recurrent or refractory Hodgkin's disease: analysis of the Stanford University results and prognostic indices. Blood 89 (3): 801-13, 1997.
- Böll B, Goergen H, Arndt N, et al.: Relapsed hodgkin lymphoma in older patients: a comprehensive analysis from the German hodgkin study group. J Clin Oncol 31 (35): 4431-7, 2013.
- Milpied N, Fielding AK, Pearce RM, et al.: Allogeneic bone marrow transplant is not better than autologous transplant for patients with relapsed Hodgkin's disease. European Group for Blood and Bone Marrow Transplantation. J Clin Oncol 14 (4): 1291-6, 1996.
- Gajewski JL, Phillips GL, Sobocinski KA, et al.: Bone marrow transplants from HLA-identical siblings in advanced Hodgkin's disease. J Clin Oncol 14 (2): 572-8, 1996.
- Kuruvilla J, Pintilie M, Stewart D, et al.: Outcomes of reduced-intensity conditioning allo-SCT for Hodgkin's lymphoma: a national review by the Canadian Blood and Marrow Transplant Group. Bone Marrow Transplant 45 (7): 1253-5, 2010.
- Peggs KS, Kayani I, Edwards N, et al.: Donor lymphocyte infusions modulate relapse risk in mixed chimeras and induce durable salvage in relapsed patients after T-cell-depleted allogeneic transplantation for Hodgkin's lymphoma. J Clin Oncol 29 (8): 971-8, 2011.
- Genadieva-Stavrik S, Boumendil A, Dreger P, et al.: Myeloablative versus reduced intensity allogeneic stem cell transplantation for relapsed/refractory Hodgkin's lymphoma in recent years: a retrospective analysis of the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Ann Oncol 27 (12): 2251-2257, 2016.
- Schmitz N, Pfistner B, Sextro M, et al.: Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin's disease: a randomised trial. Lancet 359 (9323): 2065-71, 2002.
- Rancea M, Monsef I, von Tresckow B, et al.: High-dose chemotherapy followed by autologous stem cell transplantation for patients with relapsed/refractory Hodgkin lymphoma. Cochrane Database Syst Rev 6: CD009411, 2013.
- Mundt AJ, Sibley G, Williams S, et al.: Patterns of failure following high-dose chemotherapy and autologous bone marrow transplantation with involved field radiotherapy for relapsed/refractory Hodgkin's disease. Int J Radiat Oncol Biol Phys 33 (2): 261-70, 1995.
- Poen JC, Hoppe RT, Horning SJ: High-dose therapy and autologous bone marrow transplantation for relapsed/refractory Hodgkin's disease: the impact of involved field radiotherapy on patterns of failure and survival. Int J Radiat Oncol Biol Phys 36 (1): 3-12, 1996.
- Milgrom SA, Jauhari S, Plastaras JP, et al.: A multi-institutional analysis of peritransplantation radiotherapy in patients with relapsed/refractory Hodgkin lymphoma undergoing autologous stem cell transplantation. Cancer 123 (8): 1363-1371, 2017.
- Moskowitz AJ, Hamlin PA, Perales MA, et al.: Phase II study of bendamustine in relapsed and refractory Hodgkin lymphoma. J Clin Oncol 31 (4): 456-60, 2013.
- Little R, Wittes RE, Longo DL, et al.: Vinblastine for recurrent Hodgkin's disease following autologous bone marrow transplant. J Clin Oncol 16 (2): 584-8, 1998.
- Harker WG, Kushlan P, Rosenberg SA: Combination chemotherapy for advanced Hodgkin's disease after failure of MOPP: ABVD and B-CAVe. Ann Intern Med 101 (4): 440-6, 1984.
- Tourani JM, Levy R, Colonna P, et al.: High-dose salvage chemotherapy without bone marrow transplantation for adult patients with refractory Hodgkin's disease. J Clin Oncol 10 (7): 1086-94, 1992.
- Canellos GP, Petroni GR, Barcos M, et al.: Etoposide, vinblastine, and doxorubicin: an active regimen for the treatment of Hodgkin's disease in relapse following MOPP. Cancer and Leukemia Group B. J Clin Oncol 13 (8): 2005-11, 1995.
- Longo DL, Duffey PL, Young RC, et al.: Conventional-dose salvage combination chemotherapy in patients relapsing with Hodgkin's disease after combination chemotherapy: the low probability for cure. J Clin Oncol 10 (2): 210-8, 1992.
- Ng AK, Li S, Neuberg D, et al.: Comparison of MOPP versus ABVD as salvage therapy in patients who relapse after radiation therapy alone for Hodgkin's disease. Ann Oncol 15 (2): 270-5, 2004.
- Specht L, Horwich A, Ashley S: Salvage of relapse of patients with Hodgkin's disease in clinical stages I or II who were staged with laparotomy and initially treated with radiotherapy alone. A report from the international database on Hodgkin's disease. Int J Radiat Oncol Biol Phys 30 (4): 805-11, 1994.
- Horwich A, Specht L, Ashley S: Survival analysis of patients with clinical stages I or II Hodgkin's disease who have relapsed after initial treatment with radiotherapy alone. Eur J Cancer 33 (6): 848-53, 1997.
- Uematsu M, Tarbell NJ, Silver B, et al.: Wide-field radiation therapy with or without chemotherapy for patients with Hodgkin disease in relapse after initial combination chemotherapy. Cancer 72 (1): 207-12, 1993.
- Josting A, Nogová L, Franklin J, et al.: Salvage radiotherapy in patients with relapsed and refractory Hodgkin's lymphoma: a retrospective analysis from the German Hodgkin Lymphoma Study Group. J Clin Oncol 23 (7): 1522-9, 2005.
- Herrera AF, Moskowitz AJ, Bartlett NL, et al.: Interim results of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Blood 131 (11): 1183-1194, 2018.
Tratamiento del linfoma de Hodgkin con predominio linfocítico nodular
Las diferencias inmunofenotípicas permiten diferenciar el linfoma de Hodgkin con predominio linfocítico nodular (LHPLN) (CD15-, CD20+, CD30-) del linfoma de Hodgkin (LH) clásico rico en linfocitos (CD15+, CD20-, CD30+).[
Los pacientes con LHPLN presentan enfermedad en estadio más temprano y supervivencia más prolongada que los pacientes de LH clásico.[
Opciones de tratamiento del linfoma de Hodgkin con predominio linfocítico nodular
Las opciones de tratamiento del linfoma de Hodgkin con predominio linfocítico nodular son las siguientes:
-
Conducta expectante o vigilancia activaConducta expectante o vigilancia activa . -
Radioterapia (estadio temprano)Radioterapia (estadio temprano) . -
Quimioterapia (estadio avanzado)Quimioterapia (estadio avanzado) . -
RituximabRituximab .
Conducta expectante o vigilancia activa
Debido al pronóstico favorable del LHPLN y la posibilidad de efectos secundarios a largo plazo del tratamiento, en los estudios se ha evaluado la conducta expectante o la vigilancia activa para los pacientes con enfermedad asintomática y de baja carga tumoral.[
Radioterapia
La radioterapia de campo limitado es el abordaje de tratamiento más común para los pacientes con enfermedad en estadio temprano. Este tipo histológico es raro, pero el abordaje tiene en cuenta un análisis retrospectivo que abarca varias décadas.[
Los pacientes que durante el cuadro clínico inicial no presentan una masa tumoral voluminosa, pero tienen una enfermedad con predominio linfocítico unilateral en la parte superior del cuello (por encima de la incisura tiroidea) o en sitios epitrocleares solo necesitan radioterapia dirigida al campo comprometido (RTCC).[
Quimioterapia
Para los pacientes de LHPLN en estadio temprano, la administración de doxorrubicina, bleomicina, vinblastina y dacarbazina (ABVD) durante 2 o 3 ciclos se combinó con RTCC a partir de informes anecdóticos de ensayos de grupo único.[
En los pacientes con LHPLN en estadio avanzado, es posible que sea preferible usar regímenes quimioterapéuticos, como el R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona) o el R-CVP (rituximab, ciclofosfamida, vincristina y prednisona), diseñados para pacientes de linfomas no Hodgkin de acuerdo con informes de dos revisiones retrospectivas y un estudio de fase II.[
Rituximab
En un ensayo de fase II con 39 pacientes de LHPLN en recaída o que no se habían tratado antes, la mayoría de ellos con enfermedad en estadio avanzado, se obtuvo un 100 % de tasa de respuesta mediante el tratamiento con rituximab. Luego de una mediana de seguimiento de 9,8 años, la mediana de SSP fue de 3,0 años en los pacientes que recibieron rituximab solo para la inducción, y de 5,6 años en los pacientes que recibieron rituximab para la inducción y el mantenimiento.[
Seguimiento
Aunque por lo general el pronóstico es favorable, hay una tendencia a la transformación histológica del LHPLN en un linfoma difuso de células B grandes o linfoma de células B grandes rico en células T en cerca del 10 % de los pacientes al cabo de 10 años.[
Luego de una mediana de seguimiento de 7 a 8 años, fallecieron más pacientes debido a toxicidad (aguda y tardía) relacionada con el tratamiento que por un linfoma de Hodgkin recidivante. En estos subgrupos, se debe investigar la restricción de las dosis y los campos de radiación, la evitación de fármacos quimioterapéuticos leucemógenos, y la conducta expectante.[
El abordaje de atención de la enfermedad en recaída es similar al del linfoma folicular recidivante. Según la edad y el estado funcional, algunos pacientes reciben terapias en secuencia y conducta expectante, mientras que otros pacientes reciben rescate intensivo con quimioinmunoterapia (por ejemplo con rituximab, ifosfamida, carboplatino y etopósido [R-ICE]) seguido de trasplante de células madre.[
Ensayos clínicos en curso
Realizar una
Referencias:
- Harris NL: Hodgkin's lymphomas: classification, diagnosis, and grading. Semin Hematol 36 (3): 220-32, 1999.
- Shimabukuro-Vornhagen A, Haverkamp H, Engert A, et al.: Lymphocyte-rich classical Hodgkin's lymphoma: clinical presentation and treatment outcome in 100 patients treated within German Hodgkin's Study Group trials. J Clin Oncol 23 (24): 5739-45, 2005.
- Diehl V, Sextro M, Franklin J, et al.: Clinical presentation, course, and prognostic factors in lymphocyte-predominant Hodgkin's disease and lymphocyte-rich classical Hodgkin's disease: report from the European Task Force on Lymphoma Project on Lymphocyte-Predominant Hodgkin's Disease. J Clin Oncol 17 (3): 776-83, 1999.
- Nogová L, Reineke T, Brillant C, et al.: Lymphocyte-predominant and classical Hodgkin's lymphoma: a comprehensive analysis from the German Hodgkin Study Group. J Clin Oncol 26 (3): 434-9, 2008.
- Eichenauer DA, Plütschow A, Fuchs M, et al.: Long-Term Course of Patients With Stage IA Nodular Lymphocyte-Predominant Hodgkin Lymphoma: A Report From the German Hodgkin Study Group. J Clin Oncol 33 (26): 2857-62, 2015.
- Eichenauer DA, Plütschow A, Fuchs M, et al.: Long-Term Follow-Up of Patients With Nodular Lymphocyte-Predominant Hodgkin Lymphoma Treated in the HD7 to HD15 Trials: A Report From the German Hodgkin Study Group. J Clin Oncol 38 (7): 698-705, 2020.
- Bartlett NL: Treatment of Nodular Lymphocyte Hodgkin Lymphoma: The Goldilocks Principle. J Clin Oncol 38 (7): 662-668, 2020.
- Binkley MS, Flerlage JE, Savage KJ, et al.: International Prognostic Score for Nodular Lymphocyte-Predominant Hodgkin Lymphoma. J Clin Oncol 42 (19): 2271-2280, 2024.
- Moskowitz AJ: NLP Hodgkin lymphoma: can we get away with less? Blood 135 (26): 2329-2330, 2020.
- Borchmann S, Joffe E, Moskowitz CH, et al.: Active surveillance for nodular lymphocyte-predominant Hodgkin lymphoma. Blood 133 (20): 2121-2129, 2019.
- Chen RC, Chin MS, Ng AK, et al.: Early-stage, lymphocyte-predominant Hodgkin's lymphoma: patient outcomes from a large, single-institution series with long follow-up. J Clin Oncol 28 (1): 136-41, 2010.
- Nogová L, Reineke T, Eich HT, et al.: Extended field radiotherapy, combined modality treatment or involved field radiotherapy for patients with stage IA lymphocyte-predominant Hodgkin's lymphoma: a retrospective analysis from the German Hodgkin Study Group (GHSG). Ann Oncol 16 (10): 1683-7, 2005.
- Wilder RB, Schlembach PJ, Jones D, et al.: European Organization for Research and Treatment of Cancer and Groupe d'Etude des Lymphomes de l'Adulte very favorable and favorable, lymphocyte-predominant Hodgkin disease. Cancer 94 (6): 1731-8, 2002.
- Eichenauer DA, Engert A: How I treat nodular lymphocyte-predominant Hodgkin lymphoma. Blood 136 (26): 2987-2993, 2020.
- Binkley MS, Rauf MS, Milgrom SA, et al.: Stage I-II nodular lymphocyte-predominant Hodgkin lymphoma: a multi-institutional study of adult patients by ILROG. Blood 135 (26): 2365-2374, 2020.
- Russell KJ, Hoppe RT, Colby TV, et al.: Lymphocyte predominant Hodgkin's disease: clinical presentation and results of treatment. Radiother Oncol 1 (3): 197-205, 1984.
- Aster JC: Lymphocyte-predominant Hodgkin's disease: how little therapy is enough? J Clin Oncol 17 (3): 744-6, 1999.
- Savage KJ, Skinnider B, Al-Mansour M, et al.: Treating limited-stage nodular lymphocyte predominant Hodgkin lymphoma similarly to classical Hodgkin lymphoma with ABVD may improve outcome. Blood 118 (17): 4585-90, 2011.
- Canellos GP, Mauch P: What is the appropriate systemic chemotherapy for lymphocyte-predominant Hodgkin's lymphoma? J Clin Oncol 28 (1): e8, 2010.
- Xing KH, Connors JM, Lai A, et al.: Advanced-stage nodular lymphocyte predominant Hodgkin lymphoma compared with classical Hodgkin lymphoma: a matched pair outcome analysis. Blood 123 (23): 3567-73, 2014.
- Fanale MA, Cheah CY, Rich A, et al.: Encouraging activity for R-CHOP in advanced stage nodular lymphocyte-predominant Hodgkin lymphoma. Blood 130 (4): 472-477, 2017.
- Advani RH, Horning SJ, Hoppe RT, et al.: Mature results of a phase II study of rituximab therapy for nodular lymphocyte-predominant Hodgkin lymphoma. J Clin Oncol 32 (9): 912-8, 2014.
- Al-Mansour M, Connors JM, Gascoyne RD, et al.: Transformation to aggressive lymphoma in nodular lymphocyte-predominant Hodgkin's lymphoma. J Clin Oncol 28 (5): 793-9, 2010.
- Kenderian SS, Habermann TM, Macon WR, et al.: Large B-cell transformation in nodular lymphocyte-predominant Hodgkin lymphoma: 40-year experience from a single institution. Blood 127 (16): 1960-6, 2016.
- Pellegrino B, Terrier-Lacombe MJ, Oberlin O, et al.: Lymphocyte-predominant Hodgkin's lymphoma in children: therapeutic abstention after initial lymph node resection--a Study of the French Society of Pediatric Oncology. J Clin Oncol 21 (15): 2948-52, 2003.
- Eichenauer DA, Plütschow A, Schröder L, et al.: Relapsed and refractory nodular lymphocyte-predominant Hodgkin lymphoma: an analysis from the German Hodgkin Study Group. Blood 132 (14): 1519-1525, 2018.
- Akhtar S, Montoto S, Boumendil A, et al.: High dose chemotherapy and autologous stem cell transplantation in nodular lymphocyte-predominant Hodgkin lymphoma: A retrospective study by the European society for blood and marrow transplantation-lymphoma working party. Am J Hematol 93 (1): 40-46, 2018.
Actualizaciones más recientes a este resumen (03 / 26 / 2025)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se actualizaron las
Se revisó el
Se revisó el
Se revisó el
Se revisó el
Se añadió
El
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del linfoma de Hodgkin en adultos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
El revisor principal del sumario sobre Tratamiento del linfoma de Hodgkin es:
- Eric J. Seifter, MD (Johns Hopkins University)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como "En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]".
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del linfoma de Hodgkin. Bethesda, MD: National Cancer Institute. Actualización: <MM/DD/YYYY>. Disponible en:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como "estándar" o "en evaluación clínica". Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del
Última revisión: 2025-03-26
Esta información no reemplaza el consejo de un médico. Ignite Healthwise, LLC, niega toda garantía y responsabilidad por el uso de esta información. El uso que usted haga de esta información implica que usted acepta los
Healthwise, Healthwise para cada decisión de la salud, y el logo de Healthwise son marcas de fábrica de Ignite Healthwise, LLC.
Page Footer
Quiero...
Audiencia
Sitios seguros para miembros
Información sobre The Cigna Group
Aviso legal
Los planes individuales y familiares de seguro médico y dental están asegurados por Cigna Health and Life Insurance Company (CHLIC), Cigna HealthCare of Arizona, Inc., Cigna HealthCare of Illinois, Inc., Cigna HealthCare of Georgia, Inc., Cigna HealthCare of North Carolina, Inc., Cigna HealthCare of South Carolina, Inc. y Cigna HealthCare of Texas, Inc. Los planes de beneficios de salud y de seguro de salud de grupo están asegurados o administrados por CHLIC, Connecticut General Life Insurance Company (CGLIC) o sus afiliadas (puedes ver
Todas las pólizas de seguros y los planes de beneficios de grupo contienen exclusiones y limitaciones. Para conocer la disponibilidad, los costos y detalles completos de la cobertura, comunícate con un agente autorizado o con un representante de ventas de Cigna. Este sitio web no está dirigido a los residentes de New Mexico.